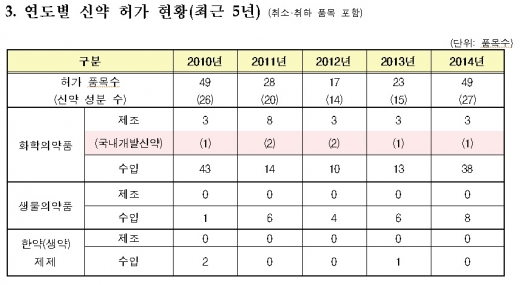
지난해 허가받은 신약 품목이 49개로 2011년 이후 가장 많은 것으로 나타났다. 특히 최근 국내에서 허가·신고된 의약품 증가세가 뚜렷해 국내 환자들에게 새로운 치료기회가 확대되고 있다는 분석이다.
식품의약품안전처 식품의약품안전평가원(이하 안전평가원)은 지난해 허가·신고된 의약품은 국내·외 신약 49개를 포함, 총 2929개였다고 14일 밝혔다. 이는 한약재(원료) 178개를 제외하고 산정한 것으로, 전체 허가·신고 품목수는 3107개였다.
전체 허가·신고 의약품 가운데 국내에서 제조된 의약품은 2709개였고, 수입 의약품은 220개였다. 또 완제의약품은 2816개(96.2%)로 대부분을 차지하고 있었고, 원료의약품은 113개(3.8%)에 불과했다. 특히 완제 중 전문의약품은 2090개, 일반의약품은 726개로 국내에서 제조하는 완제·전문의약품이 대다수를 차지하고 있는 것으로 나타났다.
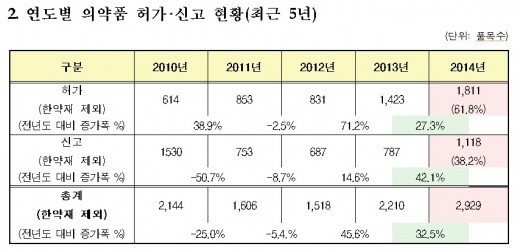
특히 국내에서 허가·신고된 의약품은 지난 2012년(1518개)부터 꾸준히 증가하고 있는 것으로 나타났다. 지난해 전체 허가·신고 품목수인 2929개는 전년인 2013년의 2210개보다 32.5% 증가, 이는 최근 5년간 가장 많은 수치다.
또 국내·외 허가 신약수는 지난 2010년 49개로 지난해와 동일했지만, 이듬 해인 2011년에는 31개, 2012년에는 17개로 감소 추세를 보였다. 그러나 2013년에는 23개로 증가하며 반등에 성공했고, 5년 만에 다시 가장 많은 수치를 기록하게 됐다.
이러한 허가·신고 품목수의 증가세는 고령화 사회에 진입함에 따라 다양한 의약품 수요를 반영한 제약회사의 제품 개발이 증가했기 때문인 것으로 풀이된다.
한편 안전평가원은 지난해 의약품 허가·신고 현황을 담아 ‘2014년 의약품 허가보고서’를 발간했다. 주요 내용은 △신약 등 일반 현황 △약효군별 현황 △화학·생물의약품, 한약(생약)제제 등 종류별 현황 △원료의약품 등록(DMF) 현황 등이다.
안전평가원 관계자는 “이번 보고서를 통해 국내 의약품 허가·신고 현황 등 관련 정보를 제공함으로써 제약기업, 학계 및 연구기관 등 관련 종사자의 의약품 개발 및 정책개발에 도움이 될 것”이라고 밝혔다.















![트럼프 美석탄 강매 으름장...“원가 지금도 높아” 곡소리 [G2 틈바구니 K-철강]](https://img.etoday.co.kr/crop/85/60/2296873.jpg)
![中 감산에 반덤핑 효과 본격화…철강업계 ’숨통’ [G2 틈바구니 K-철강]](https://img.etoday.co.kr/crop/85/60/2296874.jpg)




![레고랜드, 설 맞이 ‘브릭 체험’ 가족 나들이객 마음 훔쳤다[화보]](https://img.etoday.co.kr/crop/85/60/2296844.jpg)

![2월 둘째 주 유튜브 영상 순위 [이투PICK 순삭랭킹]](https://img.etoday.co.kr/crop/300/170/2278370.jpg)
![설 연휴 마지막, 서울역 귀경객 '북적' [포토로그]](https://img.etoday.co.kr/crop/300/190/2296862.jpg)