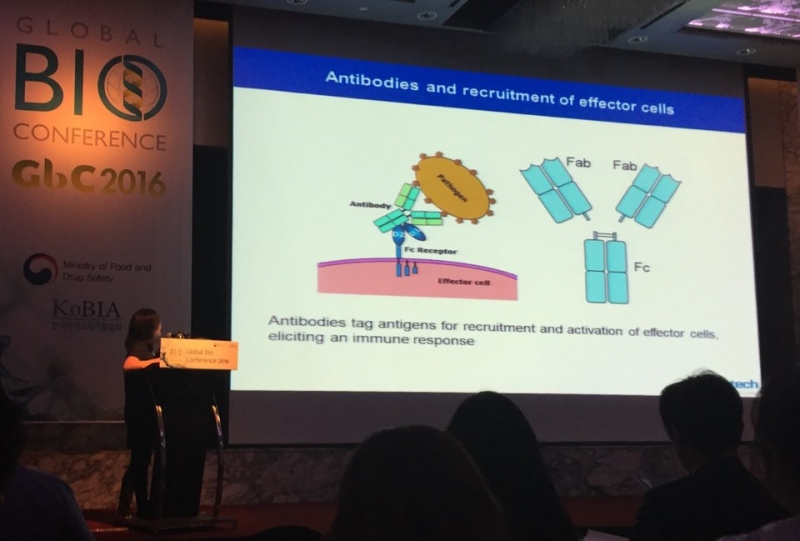
제넨텍의 연구팀은 28일 서울 코엑스에서 열린 ‘글로벌 바이오 컨퍼런스 2016’에서 알츠하이머를 치료제 개발에 대한 연구성과를 소개했다.
이승혜 제넨텍 선임연구원은 “알츠하이머의 병리기작은 세포 안에 비정상적으로 많은 양의 타우단백질(Tau protein)이 축적되고 세포사멸 등과 같은 이유로 타우단백질이 세포밖으로 퍼지는 것”이라며 “타우단백질을 표적으로 하는 항체를 통해 타우를 제거하는 효과를 확인했다”고 밝혔다.
연구팀에 따르면 알츠하이머 환자의 뇌척수액에 존재하는 타우단백질은 정상인에 비해 3배 가량 높은 것으로 관찰됐다. 타우단백질은 세포골격을 안정화시키는 것으로 알려져 있지만 결정적인 역할은 알려진 바 없다. 연구팀은 항체로 타우단백질을 억제해 신경망을 통해 확산되는 것을 막아 알츠하이머를 치료하겠다는 설명이다.
이 연구원은 “타우 항체가 세포밖에 타우단백질을 제거하는데 효과를 보였으며, 면역반응으로 치료효과를 감소시키는 것을 해결하기 위해 항체내 면역성을 일으키는 물질을 제거해 치료효과를 극대화하는데 성공했다”고 말했다.
제넨텍 연구팀은 여러 연구소와 공동으로 알츠하이머 항체치료제 개발을 진행하고 있으며 현재 생체내(in vivo) 실험과 항체의 혈액뇌장벽(BBB, Blood-Brain Barrier) 통과여부 등에 대한 연구를 진행중이다.
이 연구원은 “BBB 통과여부는 뇌질환 치료제가 극복해야 할 큰 과제중 하나”라며 “이에 대한 연구가 진행중”이라고 말했다. 대부분의 뇌 세포는 재생 능력이 없어 다른 신체 부위에 비해 면역 작용이 활발하지 않은 대신 BBB라는 탄탄한 1차 장벽을 가지고 있어 에너지원인 포도당을 포함한 선택된 소수의 물질만이 BBB를 통과할 수 있다. 이런 이유로 뇌를 타깃으로 하는 치료제를 만들 때 BBB 통과 여부가 관건이다.
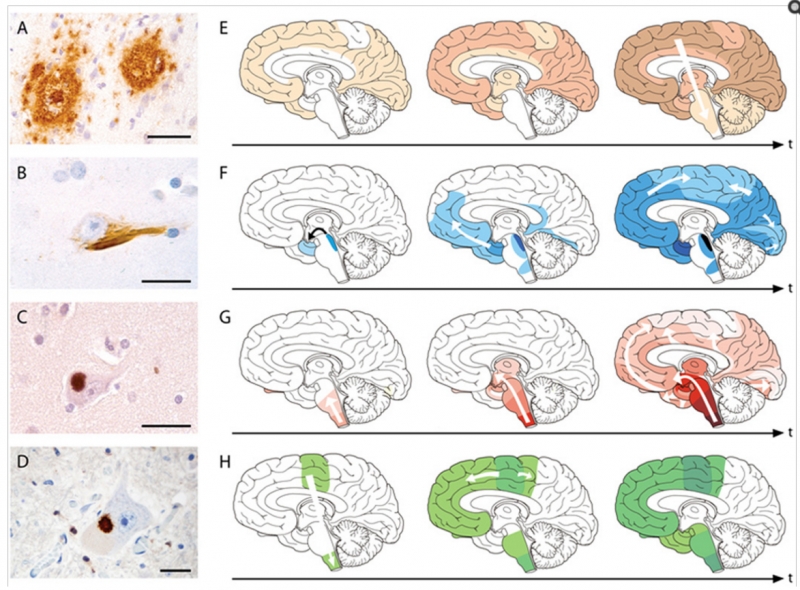
한편 퇴행성 뇌질환의 원인은 특정 단백질의 축적에 의한 것이라고 이 연구원은 설명했다. 나이가 들면서 특정 단백질의 이상 구조로 인해 단백질이 응집되고 결국 이로 인해 뇌가 손상된다는 것.
아래 그림을 보면 처음 국소적인 부위에 머물렀던 특정 단백질 분포가 점점 뇌 전체로 퍼지게 되는데, 이는 퇴행성 뇌질환에서 가장 보편적으로 관찰되는 현상이라는 설명. A, B는 알츠하이머 환자의 뇌고 C는 파킨슨병, D는 루게릭병 환자의 뇌다. 모두 시간이 흐름에 따라 단백질이 분포하는 범위가 넓어짐을 볼 수 있다.














![“생활 밀접한 시스템부터 단계적 도입” [비용의 덫, 보안인증 의무화 역설]](https://img.etoday.co.kr/crop/85/60/2296900.jpg)
![‘1500만원’ 보안인증 컨설팅비는 최대 7억 [비용의 덫, 보안인증 의무화 역설]](https://img.etoday.co.kr/crop/85/60/2296897.jpg)

![김흥태 이뮨온시아 대표 “면역항암제 조기 출시⋯기술수출 가시권”[상장 새내기 바이오③]](https://img.etoday.co.kr/crop/85/60/2296868.jpg)




![2월 둘째 주 유튜브 영상 순위 [이투PICK 순삭랭킹]](https://img.etoday.co.kr/crop/300/170/2278370.jpg)
![설 연휴 마지막, 서울역 귀경객 '북적' [포토로그]](https://img.etoday.co.kr/crop/300/190/2296862.jpg)