환자가 말기암 등으로 생명에 위급한, 게다가 마땅한 치료방법이 없는 상황에서 의사의 마지막 선택 중 하나는 임상시험 중인 의약품을 사용해보는 것이다. 담당 주치의는 이 의약품이 시판되거나 해당 질환에 적응증을 인정받지는 않았지만 임상 과정에서 확인한 효능이 환자의 생명연장에 도움이 되길 기대하면서 처방을 결정한다.
식품의약품안전처에서는 이러한 요구에 부응하기 위해 '임상시험용 의약품 응급사용 승인제도'를 운영하고 있다. 임상현장에서는 '응급임상'이 불린다. 그렇다면 국내 의사들은 응급임상에서 어떤 의약품을 선택했을까? 특히 국내 제약바이오기업의 의약품은 응급임상에서 얼마나 많은 의사들에게 활용되고 있을까?
국내기업으로는 한미약품 젬백스 코미팜 신라젠 코아스템 다국적제약 기업으로는 베링거인겔하임, 노바티스, 아스트라제네카 등이 처방 리스트에 이름을 올린 것으로 나타났다.
◇한미약품 '올리타' 국내기업 응급임상 승인 최다
바이오스펙테이터는 7일 국회의 협조를 받아 2013년부터 2016년 6월까지 식약처의 임상시험용 의약품 승인 내역을 확인했다. 이 가운데 의사들이 가장 많이 찾은 국내 기업의 신약은 한미약품의 'HM61713(프로젝트명)'으로로 나타났다. 지난 6월초 '올리타'라는 이름으로 국내 시판된 내성표적 폐암신약이다.
HM61713은 2014년부터 올해 6월까지 총 266건이 승인된 것으로 집계됐다. 특히 2014년 67건에서 2015년 105건, 2016년(6월말기준) 94건으로 사용량이 꾸준히 느는 추세다.
HM61713은 작년 7월 독일 제약사 베링거인겔하임과 약 8500억원 규모의 글로벌 라이선스 계약을 체결해 주목받았다. 최근에는 국내 신약 중 최초로 미국에서 '혁신치료제'로 지정되기도 했다. 이런 성과들이 국내 의사들의 응급사용 경향에서도 고스란히 드러난 것이다.
한미약품이 미국 스펙트럼사와 공동 개발 중인 다중표적 항암신약 HMI781-36B(포지오티닙)도 2014년 8건, 2015년 7건, 2106년 2건이 승인받았다. 포지오티닙은 국내외에서 임상 2상이 진행되고 있으며 기존치료제에 내성이 생긴 유방암, 비소세포폐암환자의 새로운 치료대안으로 주목받고 있다.
젬백스&카엘의 면역함암제 '리아백스(GV1001)'가 한미약품 다음이었다. 응급임상으로 처방된 리아백스는 2014년 5건에 불과했으나 2015년 56건, 2016년 21건으로 처방량이 급증했다.
리아백스는 2014년 이오탁신 지표가 높은 환자를 대상으로 유효성을 입증하는 3상 임상시험을 병행하는 조건으로 시판허가를 받은 췌장암 치료제다. 면역체계에 반응하는 항암제라는 점에서 췌장암이 아닌 다른 암에도 폭넓게 사용되면서 처방량이 늘었다. 리아백스는 현재 전립선비대증으로 적응증을 확대하는 임상도 진행 중이다.
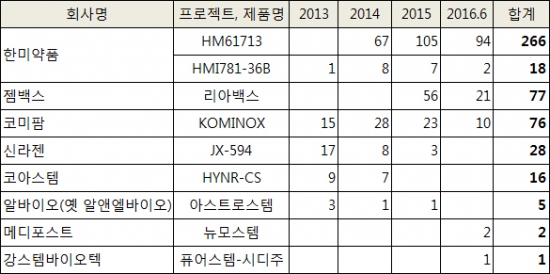
이외에도 코아스템의 루게릭병 치료제 HYNR-CS(16건), 알바이오(옛 알앤엘바이오)의 아스트로스템(5건), 메디포스트의 뉴모스템(2건) 강스템바이오텍의 퓨어스템-시디주(1건) 등이 임상 승인 리스트에 이름을 올렸다.
◇베링거인겔하임 '오페브' 2년 6개월간 532건 승인
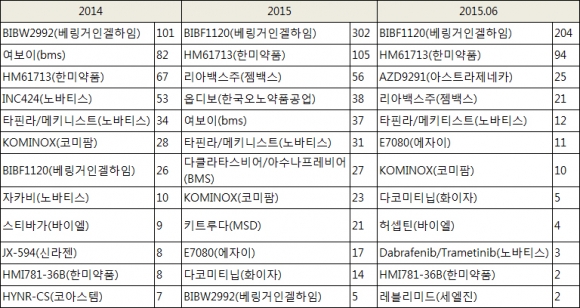
그렇다면 국내 임상현장에서 가장 많이 승인받은 응급사용 의약품은 무엇일까? 다국적제약회사인 베링거인겔하임의 특발성폐섬유화증 치료제 BIBF1120(성분명 닌텐다닙, 제품명 오페브)으로 2014년 처음 처방된 이후 2년 6개월동안 532건이 승인받았다.
이 약은 FDA로부터 2014년 10월 시판 허가 받았다. 국내의 경우 식약처에 시판허가 신청서를 제출한 상태로 현재 심사절차를 밟고 있다. 같은 회사의 폐암 표적치료제 BIBW2992(성분명 아파티닙, 제품명 지오트립) 역시 249건이 승인받아 환자에게 투여된 것으로 집계됐다.
면역항암제 3총사로 불리는 여보이(119건) 옵디보(39건) 키트루다(21건) 등도 국내 의사들이 선택한 응급임상 의약품 리스트에 이름을 올렸다. 노바티스의 골수섬유증 치료제 INC424(상품명 자카비, 120건), 흑색종치료제 타핀라+메키니스트(65건) 아스트라제네카의 폐암치료제 AZD9291(25건) 등도 활용됐다.
임상시험용 의약품 응급사용 승인제도는 의사, 환자, 제약사 모두가 윈윈이다. 의사와 환자에게는 새로운 대체치료법의 가능성을 열어 준다는 점에서 제약사에게는 신약 허가시 처방 확대와 적응증 확대에 유리하다는 점에서 긍정적인 측면이 있다.
그렇다고 임상시험중인 모든 의약품이 활용되는 것은 아니다. 한 대학병원 교수는 "응급임상 의약품은 중대한 부작용이 없어 안전성이 보장되고 면역항암제와 같이 적응증 확대 가능성이 높은 의약품이 많이 활용된다"면서 "처방의사가 약에 대한 매커니즘을 이해하고 어느정도 확신이 있어야 사용 가능하다"고 말했다.
다만 임상의약품을 무상제공해야 하기 때문에 기업 입장에서도 무작정 확대에 부담이 있다. 이 때문에 자금력을 보유한 다국적 제약사 등이 이 제도를 활용하기에 유리한 측면이 있다. 일각에서는 임상의약품 응급사용 승인 절차가 복잡하고 기업의 부담이 크다며 제도 개선을 요구하는 목소리도 나오고 있다.


![한국 첫 메달은 스노보드 김상겸…오늘(9일)의 주요일정 [2026 동계올림픽]](https://img.etoday.co.kr/crop/140/88/2293019.jpg)
![[단독] 신용보증기금, 전사 AI 통합 플랫폼 만든다⋯‘금융 AX’ 모델 제시](https://img.etoday.co.kr/crop/140/88/2292951.jpg)
![강남권 매물 늘었는데⋯고위공직자 선택 주목 [고위공직 다주택자 시험대①]](https://img.etoday.co.kr/crop/140/88/2292959.jpg)
![[날씨] 월요일 출근길 체감온도 '영하 15도'…강추위 낮부터 풀린다](https://img.etoday.co.kr/crop/140/88/2292831.jpg)
!['김건희 집사' 김예성 선고...'삼성전자 특허 유출' 안승호 전 부사장 1심 결론 [이주의 재판]](https://img.etoday.co.kr/crop/140/88/2229916.jpg)
![[주간수급리포트] 외국인과 맞붙은 개미…삼전·SK하닉 선택 결과는?](https://img.etoday.co.kr/crop/140/88/2292971.jpg)





![[BioS]이수앱지스, 갤럭스와 'AI기반' 희귀질환치료제 개발](https://img.etoday.co.kr/crop/85/60/2293303.jpg)









![[찐코노미] 엔비디아 '알파마요' 부상…테슬라 FSD 경쟁 구도에 변수](https://img.etoday.co.kr/crop/300/170/2293226.jpg)
!['주유소 기름값 9주 연속 하락세' [포토로그]](https://img.etoday.co.kr/crop/300/190/2292925.jpg)