
젬백스앤카엘은 지난 22일 식품의약품안전처로부터 GV1001의 치료효과 검증을 위한 알츠하이머병 2상 시험에 대한 임상시험계획서를 승인받아 내년 3월부터 본격적인 알츠하이머질환 임상시험에 돌입한다고 26일 밝혔다.
이번 임상시험은 한양대학교 구리병원 외 3개 기관에서 GV1001 투여군에 대한 유효성 및 안전성 평가를 목적으로 시행될 예정이며, 임상시험에 쓰일 약물은 췌장암치료제로 국내 삼성제약에서 생산될 예정이다.
알츠하이머는 치매를 일으키는 가장 흔한 퇴행성 뇌질환으로 고령화사회에 접어들면서 유병률이 빠르게 증가하고 있다. 알츠하이머의 병리기전을 나타내는 데 핵심적인 요소는 베타아밀로이드(β-amyloid)와 타우(Tau)로, 두 단백질이 응집∙확산돼 신경세포에서 과다한 염증반응이 나타나 세포사멸에 이르게 된다. 현재 시판중인 약물들은 알츠하이머병에 대한 근본적인 치료가 아닌, 증상을 완화시키고 병의 진행을 지연시키는 약물들로 1998년부터 2011년까지 100여개 이상의 시도 중 단 4개의 약물만이 승인받은 바 있다.
젬백스 전임상은 한양대 이규용, 고성호 교수팀과 공동으로 진행했다. 연구팀은 전임상에서 베타아밀로이드 처리군에 GV1001를 추가적으로 가할 경우 세포사멸에 관련된 유전자가 감소했으며 실제 세포사멸이 억제(TUNEL assay)됨을 관찰했다. 또한 실제 알츠하이머 동물모델에서 GV1001 주입에 따른 베타아밀로이드와 타우 응집에 따른 신경세포 응축(Neurofibrillary tangle) 현상이 억제됨을 확인했다.
송형곤 사장은 "현재 시판되거나 연구중인 대부분의 알츠하이머병 치료제는 초기 환자를 대상으로 하지만 GV1001은 중/말기 환자가 대상"이라면서 "이미 연구를 통하여 입증된 GV1001의 알츠하이머병의 병리 기전에 대한 여러 효과를 고려한다면 충분히 가능성이 있을 것"이라고 말했다.
또한 송 사장은 국내 임상시험 진행과 동시에 글로벌 시장 진출을 위한 구체적인 준비도 하고 있다며 궁극적으로는 알츠하이머병의 글로벌 시장 진출이 목표라고 전했다. 회사는 향후 미국에서도 임상2상을 진행할 계획이다.
젬백스는 GV1001(테르토모타이드)이 가진 다면발현성의 가능성을 보고 현재 전립선 비대증 치료제로 국내 임상2상을 진행 중이다.
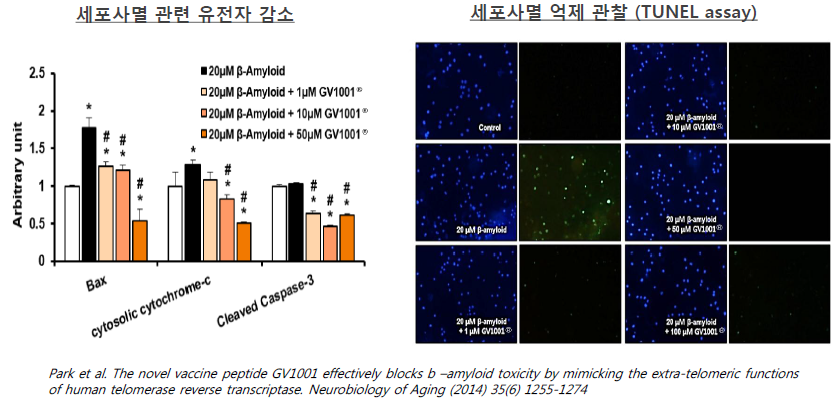
GV1001은 어떤 작용기전을 갖고 있을까? GV1001은 '생체시계’라 불리는 텔로미어를 합성하는 효소인 텔로머라아제에서 모티브를 따온 물질이다.
일반적인 상태에서는 생체 내 효소인 텔로머라아제에 대해 면역반응을 일으키지 않지만 이를 구성하는 일부 펩타이드를 ‘항원’으로 주입해 면역세포를 활성화하는 원리다. GV1001은 텔로머라아제의 구성 요소 중 인체 내에서 면역원성이 상대적으로 큰 16개의 아미노산(단백질 최소단위)으로 이뤄진 펩타이드이다.
텔로머라아제가 텔로미어를 합성하기 위해선 유전정보(RNA)와 이를 바탕으로 텔로미어 DNA 서열을 합성하는 역전사 효소 TERT(telomere-elongating reverse transcriptase enzyme)로 구성된다. GV1001은 TERT의 611-626번째 아미노산으로 구성된 물질로 TERT를 구성하는 여러가지 후보 물질 중 T세포가 가장 크게 반응하는 펩타이드를 선정한 것이다.
GV1001를 피내주사로 체내에 주입하면, 수지상세포가 이를 항원으로 인식해 결과적으로 T세포를 포함한 면역세포를 활성물질이다. GV1001에 의해 암세포를 직접 공격해 제거하는 세포독성 T세포(CD8+림프구)가 활성∙증식하고 TNF-α, IL-2를 포함한 다양한 면역 활성분자가 분비되는 것을 확인했다.
이 뿐만이 아니다. 보조 T세포(CD4+림프구)가 활성화돼 세포독성 T세포가 감염성 입자를 없앨 수 있도록 신호를 보내고 면역체계를 활성화하는 분자를 내뿜는다. 이 두 가지 T세포 반응을 통해 항암작용과 T세포가 항원을 기억하게 하는 원리다.
젬백스가 선택한 췌장암은 암 조직 중 가장 높은 95%의 텔로머라아제 발현율을 보인다. 젬백스는 추가적으로 비소폐암, 흑색종, 간암에서 GV1001의 임상을 진행한 바 있으며 향후 비소폐암을 우선으로 면역항암치료제로써 적응증을 확대할 계획이다.
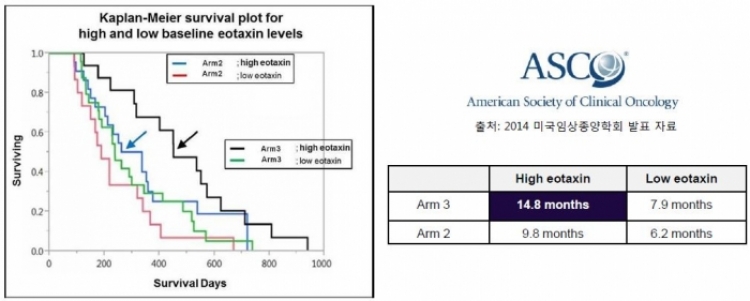
한편, GV1001은 이오탁신을 바이오마커로 규명, 이를 근거로 2014년 9월 식품의약품안전처로부터 이오탁신 지표가 높은 환자를 대상으로 유효성을 입증하는 3상 임상시험을 병행하는 조건으로 리아백스주(품목명) 시판허가를 받은바 있다.
리아백스주는 국내 16개 기관에서 임상 3상을 진행중이며 총 148명을 목표로 젬시타빈/카페시타빈 대비 병용투여 했을 때의 유효성 및 안정성을 평가하고 있으며, 2018년 임상종료 예정이다.





![명절에 선물 받은 건강기능식품, 약과 함께 먹어도 될까? [e건강~쏙]](https://img.etoday.co.kr/crop/140/88/2297575.jpg)
![가상자산 매도 물량 나올만큼 나왔다…저점 탐색 구간[머니 대이동 2026 下-③]](https://img.etoday.co.kr/crop/140/88/2297240.jpg)
![갈수록 커지는 IP 분쟁...중심엔 AI [글로벌 IP전쟁 ①]](https://img.etoday.co.kr/crop/140/88/2297385.jpg)
![여자 컬링 4강 진출 좌절…오늘(20일)의 경기 일정 [2026 동계올림픽]](https://img.etoday.co.kr/crop/140/88/2297449.jpg)








![CJ웰케어 ‘이너비 피디알엔 리즈’ㆍ배스킨라빈스 ‘쫀떡 만난 흑임자’ 외 [나왔다 신상]](https://img.etoday.co.kr/crop/85/60/2297347.jpg)
![명절에 선물 받은 건강기능식품, 약과 함께 먹어도 될까? [e건강~쏙]](https://img.etoday.co.kr/crop/85/60/2297575.jpg)




![현대차, 피지컬 AI로 판 뒤집나…"목표주가는 아직 레거시" [찐코노미]](https://img.etoday.co.kr/crop/300/170/2297523.jpg)
!['내란 우두머리' 윤석열 1심 무기징역 선고 [포토]](https://img.etoday.co.kr/crop/300/190/2297369.jpg)