국내 바이오업체 젬백스가 개발한 췌장암치료제 ‘리아백스’가 올해 들어 총 57건의 임상의약품 응급상황 사용승인을 받은 것으로 나타났다. 전체 승인 건수 8건 중 1건을 차지할 정도로 응급상황에서 사용 빈도가 높다. 이미 보건당국으로부터 시판승인을 받았지만 의료 현장에서 긴급한 상황에서 리아백스를 사용하려는 수요가 높아 임상의약품을 사용 시도가 많은 것으로 분석된다.
11일 식품의약품안전처에 따르면 올해 승인받은 ‘응급상황 또는 치료목적 임상시험용의약품’은 총 450건으로 나타났다.
‘임상시험의약품의 응급상황 또는 치료목적 사용승인’(응급임상)은 말기 암 등으로 생명이 위급하거나 다른 치료방법이 없는 환자에게 치료기회를 제공하기 위해 원칙적으로 임상시험용만으로 사용할 수 있는 의약품을 품목 허가를 받기 전에 사용할 수 있도록 승인하는 제도다.
응급상황 사용승인은 의사가 더 이상 치료수단 등이 없는 환자에 대해 임상시험용의약품 사용이 필요하다고 판단하는 경우 진단서, 환자 동의서, 제약업체 등으로 부터 받은 임상시험용의약품 제공 의향서 등을 준비, 식약처에 신청 후 승인받아 사용하면 된다.
식약처는 지난 10일부터 응급환자들이나 대체 치료수단이 없는 환자 등의 치료기회 확대를 위해 응급임상 승인 현황을 공개했다.
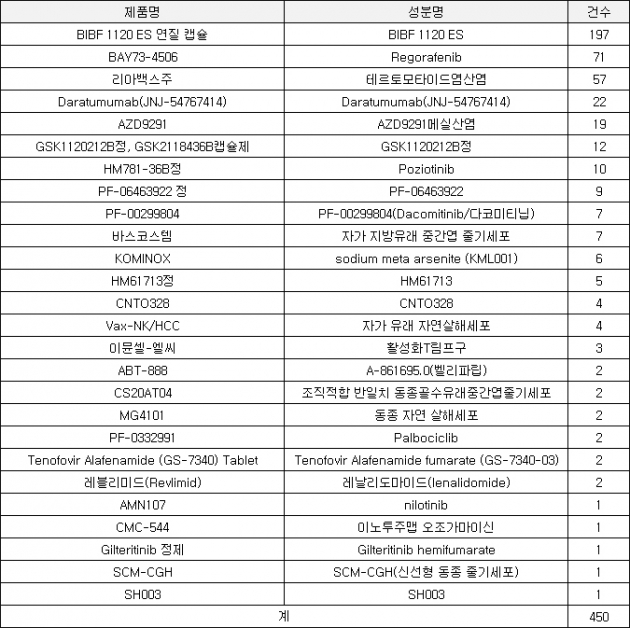
이 자료를 보면 올해 ‘BIBF 1120 ES’가 가장 많은 197건의 임상의약품이 응급 사용승인을 승인받았다. ‘닌테다닙’ 성분의 이 제품은 베링거인겔하임이 개발한 특발성폐섬유화증 치료제다. 특발성폐섬유증(IPF)은 알 수 없는 원인으로 인해 폐포(허파꽈리) 벽이 딱딱하게 굳어가면서 폐 기능을 저하시켜 신체 주요 장기로 공급하는 산소의 양을 감소시킴으로써 서서히 사망에 이르게 하는 만성 진행성 폐질환이다. 미국에서는 지난 2014년, 국내에서는 지난해 ‘오페브’라는 제품명으로 허가받았다. 오페브는 지난해에도 가장 많은 438건의 응급임상 승인을 받았다. 전체 승인 793건의 절반이 넘는다.
‘레고라페닙’ 성분의 ‘BAY73-4506'은 올해 71건의 응급임상 승인을 받았다. 바이엘이 지난 2013년 ’스티바가‘라는 제품명으로 국내 승인을 받은 이 약물은 전이성직장결장암 등에 사용된다.
바이오업체 젬백스가 개발한 항암제 ‘리아백스’가 올해 57건 응급임상 승인을 받았다는 점이 눈에 띈다. 국내업체가 개발한 제품 중 가장 많은 승인을 받았고 전체 응급상황 사용 승인 건수의 12.7%를 차지할 정도로 응급상황에서 수요가 많았다는 의미다. 리아백스는 지난해에도 60건의 임상의약품이 응급임상 승인을 받았다.
지난 2015년 조건부허가를 받은 리아백스는 ‘혈청 이오탁신 농도가 81.02pg/mL 초과인 국소진행성 또는 전이성 췌장암 환자의 치료’ 용도로 조건부허가를 받았다.
리아백스 역시 오페브와 스티바가와 마찬가지로 시판 승인을 받아 시중에서 판매 중인데도 응급임상 승인을 받았다는 점이 이색적이다. 원칙적으로 응급임상은 시판허가를 받기 전인 약물을 대상으로 승인받을 수 있기 때문이다.
식약처 관계자는 "시판승인을 받은 약물이라도 치료현장에서 대체 약물이 없어 마지막으로 긴급하게 사용하기 위해 임상시험약의 응급상황 사용을 승인받아 사용한다"라고 설명했다.
응급임상의 특징상 치료제가 없는 환자들에 마지막 대안으로 리아백스를 사용하려는 수요가 높은 것으로 추정된다. 현재 췌장암은 근본적인 치료제가 등장하지 않은 실정이다. 예를 들어 췌장암 말기 환자가 더 이상 사용할 수 있는 약이 없는 상황에서 리아백스의 임상시험이 진행 중일 때 의료진의 판단 하에 긴급하게 임상시험용의약품을 공급받아 사용한 사례가 많은 것으로 관측된다. 더 이상 치료제가 없는 상황에서 마지막으로 리아백스를 사용해보려는 수요가 많다는 해석이 가능하다.
리아백스의 까다로운 사용 요건도 응급임상의 수요가 많은 요인으로 지목된다. 식약처 관게자는 “리아백스는 조건부승인을 받으면서 임상시험을 진행하는 의료기관에서만 사용이 가능하도록 허가받았다”고 설명했다. 리아백스의 임상시험을 수행하지 않는 의료기관에서는 응급임상 이외에는 리아백스를 사용할 수 없다는 의미다. 다만 임상시험의약품의 응급상황 사용은 제약사가 무상으로 공급하기 때문에 많은 건수의 응급임상이 해당 업체의 매출로 이어지지는 않는다.
국내 업체 중 한미약품의 ‘포지오티닙’이 올해 10건의 응급임상 승인을 받았다. 포지오티닙은 다양한 암에서 관찰되는 HER 단백질을 표적으로 하는 표적항암신약이다. 한미약품이 2015년 미국 제약사 스펙트럼에 기술수출한 이후 해외에서도 유방암, 비소세포폐암 환자를 대상으로 임상시험이 진행 중이다.
알바이오의 줄기세포치료제 ‘바스코스템’과 한미약품의 항암제 ‘올리타(HM61713)’는 각각 7건, 5건의 응급임상 승인을 받았다. 녹십자셀의 면역세포치료제 ‘이뮨셀엘씨’도 응급임상 승인을 받고 3차례 사용됐다.


![[종합] 현대차그룹, 새만금에 9조 투자…로봇·AI·수소 ‘미래산업 전초기지’ 구축](https://img.etoday.co.kr/crop/140/88/2289853.jpg)

![“은퇴 자산관리, ‘절약’보다 ‘전략’ 중요⋯퇴직하고도 월급 받도록 설계해야” [와이즈포럼]](https://img.etoday.co.kr/crop/140/88/2301292.jpg)


![김범석 쿠팡 의장 “개인정보 유출 사과”⋯첫 육성 입장 발표 [쿠팡 컨콜]](https://img.etoday.co.kr/crop/140/88/2208622.jpg)







![중동 정세 악화에 국내 기업 ‘비상’…현지 인력 안전 점검 [하메네이 사망]](https://img.etoday.co.kr/crop/85/60/2301458.jpg)
![호르무즈 봉쇄 현실화에…韓 정유·항공·해운 ‘동시다발 비상’ [하메네이 사망]](https://img.etoday.co.kr/crop/85/60/2301498.jpg)

![애플도 따라하기 어렵다…삼성전자 “프라이버시 디스플레이 특허 대거 등록” [언팩 2026]](https://img.etoday.co.kr/crop/85/60/2301490.jpg)




![코스닥 자금 몰린다…에코프로 중심 2차전지 재부상 [찐코노미]](https://img.etoday.co.kr/crop/300/170/2301304.jpg)
![와이즈포럼 ‘미래에셋과 함께하는 연금·ETF 투자전략’ [포토]](https://img.etoday.co.kr/crop/300/190/2301262.jpg)