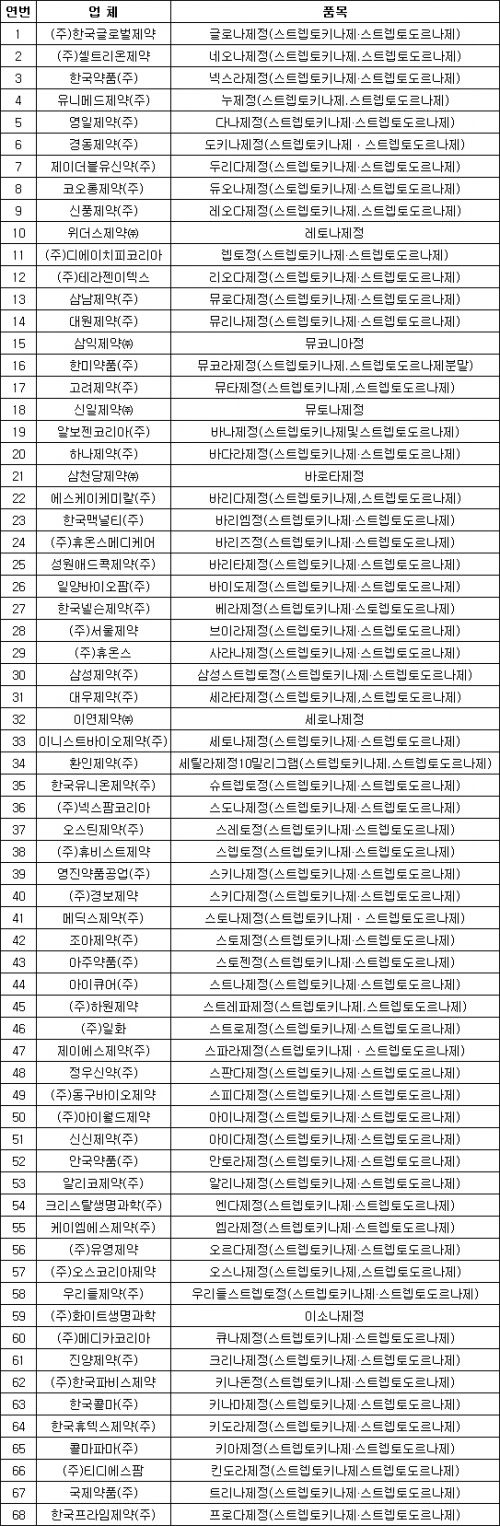
염증성 질환 치료제로 사용되는 ‘스티렙토키나제·스티렙토도르나제’ 성분 의약품 68개 제품이 효능 재검증을 위한 임상시험에 들어간다. 보건당국의 효능 검증 과정에서 유용성을 인정할만한 근거가 부족하다는 판단에서다. 최신 과학 수준에서 검증되지 않은 의약품을 국민들이 복용한 ‘안전관리 사각지대’가 발생했다는 지적이 나온다. 최근 본격 시행된 의약품 품목 갱신제의 도입으로 반복되는 시판 의약품의 효능 논란이 개선될 것이란 전망도 제기된다.
31일 업계에 따르면 식품의약품안전처는 최근 스티렙토키나제·스티렙토도르나제 성분 의약품 68개 품목에 대해 임상 재평가를 실시한다고 공고했다. 임상시험을 통해 효능·효과를 입증할만한 자료를 제출하라고 해당 제약사에 지시한 것이다. 이 약물을 판매 중인 68개사는 오는 10월20일까지 임상시험 계획서를 식약처에 제출해야 한다.

임상재평가 실시는 식약처의 문헌재평가 결과에 따른 조치다. 식약처는 지난해 의약품 재평가를 진행하면서 스티렙토키나제·스티렙토도르나제 성분 제품도 효능·효과를 입증할만한 근거를 제출하도록 지시했다. 제약사들은 임상시험 결과를 통한 안전성·유효성 자료를 제출하거나 해외에서 판매 중인 근거를 제시하면 계속 판매할 수 있다. 하지만 충분한 자료를 제시하지 못해 임상재평가를 통한 효능 재검증 지시가 이뤄졌다.
식약처는 원칙적으로 미국, 일본, 캐나다, 영국, 프랑스, 독일, 이탈리아, 캐나다 등 G7 국가의 의약품집에 수재돼 있으면 국내에서도 유용성을 인정해준다. 하지만 이번에 재평가를 진행하면서 스티렙토키나제·스티렙토도르나제 성분 의약품은 G7국가 어디에서도 판매하지 않은 것으로 드러났다.
식약처 관계자는 “당초 스티렙토키나제·스티렙토도르나제 약물이 허가받을 때 독일 의약품집 수재를 근거로 제시했는데, 이번에 재평가를 진행하면서 독일에서도 이 약물을 판매하지 않은 것으로 나타났다”라고 설명했다. 이 약물은 멕시코, 베트남, 에콰도르 등에서는 판매되는 것으로 알려졌다.
업계 일각에서는 유효성·안전성 근거가 없는 제품을 그동안 국민들이 복용한 것이 아니냐는 의혹의 시선을 제기하기도 한다.
‘스티렙토키나제·스티렙토도르나제’ 성분 의약품이 언제부터 해외에서 판매가 중단됐는지는 파악되지 않은 상태다. 이 약물의 오리지널 의약품은 SK케미칼의 ‘바리다제정’이지만 SK케미칼 측은 유용성 근거를 찾지 못한 상태다.
SK케미칼이 직접 이 약물을 허가받지는 않았기 때문이다. 당초 동신제약이 이 약물을 가장 먼저 국내에서 판매하기 시작했는데 SK케미칼은 지난 2006년 동신제약을 인수했다.
SK케미칼 관계자는 “최신 과학수준에서 유용성을 판단하기 위해 재평가를 진행했고, 허가받을 당시에는 충분한 자료를 제시했기 때문에 효과가 없는 약물은 아니다”라고 설명했다.
식약처는 전문가 자문 회의인 중앙약사심의위원회를 열고 이 약물을 처방하는 전문의들의 의견을 수렴한 결과 처방현장에서는 스티렙토키나제·스티렙토도르나제가 유용성이 있다고 판단했다. 다만 현재로서는 유용성을 뒷받침할만한 근거가 없기 때문에 이 약물을 판매하는 업체들에 임상시험을 진행하고 효능·효과를 입증하라고 지시한 것이다.
사실 시판 중인 의약품의 재평가 과정에서 유용성 근거자료를 찾지 못해 시장에서 퇴출되거나 적응증이 수정되는 사례는 비일비재했다.
잇몸약 '인사돌'이 대표적이다. 식약처는 뒤늦게 인사돌의 원 개발국에서 판매가 중단됐다는 사실을 인지하고 임상재평가를 통해 적응증을 수정했다.
애초 동국제약은 지난 1977년 프랑스에서 수입한 인사돌을 치은염, 치주증 등 치주질환에 사용하는 일반의약품으로 허가받았다. 이때 프랑스에서 같은 효능·효과를 인정받았다는 게 국내 허가의 근거다. 하지만 2011년 프랑스에서 인사돌의 판매가 중단되면서 상황이 달라졌다.
프랑스 보건당국은 2004년 개정된 식물기반 의약품의 허가 규정에 따라 2011년 4월30일까지 효능을 입증할만한 자료를 제출토록 인사돌의 프랑스 현지의 최초 개발사에 요구했는데, 이 업체가 관련 서류를 제출하지 않았다. 결국 2011년 5월부터 인사돌은 프랑스에서 건강기능식품으로만 판매됐다.
당시 식약처는 "3년 전에 프랑스에서 인사돌의 효능에 대한 근거가 사라졌다"는 지적이 제기되자 동국제약 등에 치주염 등을 입증할만한 임상시험 자료를 제출토록 지시했다. 지난해 임상재평가 결과 인사돌과 동일 성분의 의약품에 대해 적응증을 '치주질환(치아지지조직 질환, 치은염, 치주증)'에서 '치주치료 후 치은염, 경·중등도 치주염의 보조치료'로 변경했다.
식약처는 최근 본격 시행된 의약품 품목 갱신제로 재평가 과정에서 반복되는 시판 의약품의 효능 논란이 해소될 것으로 기대하는 눈치다.
지난 2012년 약사법 개정을 통해 근거가 마련된 의약품 품목 갱신제는 보건당국으로부터 허가받은 의약품은 5년 마다 효능·안전성을 재입증해야 허가가 유지되는 내용이 핵심이다.
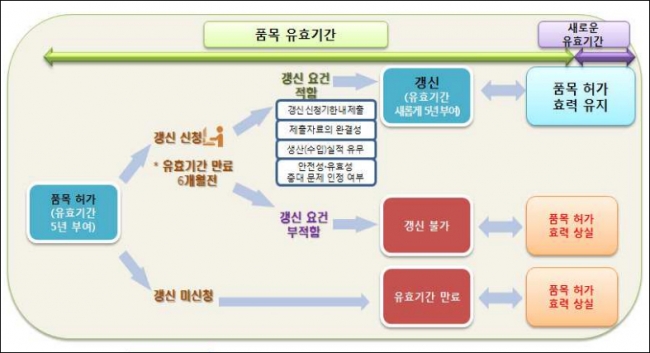
기존에 시판중인 의약품은 재평가라는 절차를 통해 16~20년에 한번 정도 안전성과 유효성을 검증받았다. 하지만 급속한 과학 발전에 따른 합리적인 평가체계 운영이 필요하다고 판단, 갱신제를 도입했다.
2013년 1월1일부터 허가받은 의약품은 5년 마다 안전성·효능 관련 자료를 제출하고 식약처로부터 적합 판정을 받아야만 판매가 유지된다. 2013년 이전에 허가받은 의약품은 식약처가 별도로 지정한 분류번호에 따라 2018년 9월30일부터 품목 갱신 관련 자료를 제출해야 한다.
5년의 유효기간 동안 수집된 안전관리에 관한 자료 및 조치계획, 외국에서의 사용현황 및 안전성 관련 조치에 관한 자료, 유효기간 동안 수집된 품질관리에 관한 자료, 제조·수입 실적에 관한 자료 등이 자료 제출 대상이다.
제약사들은 품목 갱신 자료를 유효기간 6개월 전에 제출해야 한다. 2013년 1월 1일 허가받은 의약품은 2018년 1월 1일까지 허가가 유효하지만, 품목을 갱신받으려면 유효기간 6개월 전인 2017년 7월1일까지 자료를 제출해야 한다는 얘기다. 지난 7월부터 제약사들이 품목 갱신자료를 제출을 시작하며 본격적으로 품목 갱신제가 시행됐다.
식약처 관계자는 “품목 갱신제로 시판 중인 의약품은 5년마다 재검증을 받아야만 판매를 계속할 수 있다. 최신 과학 수준에서 유효성·안전성을 인정받은 의약품만 판매가 가능하게 된다”라고 말했다.





![95% 치료제 없는 ‘이 분야’…K바이오에 기회될까 [800兆 희귀질환 시장]](https://img.etoday.co.kr/crop/140/88/2299281.jpg)
![출근길 짙은 안개·빙판길 주의…낮부터 포근 [날씨]](https://img.etoday.co.kr/crop/140/88/2242898.jpg)
![개미도 비상장 벤처 투자… 내달 'BDC' 첫선[개인 벤처투자路①]](https://img.etoday.co.kr/crop/140/88/2299217.jpg)
![“부산까지 2시간 30분"...인천발 KTX 직결 [집값은 철길을 타고④]](https://img.etoday.co.kr/crop/140/88/2299298.jpg)



![현대차 주가, 이제 '숫자'로 보지 마세요. 삼성전자보다 무서운 진짜 이유 [찐코노미]](https://i.ytimg.com/vi/TfLr6_Ne1wA/mqdefault.jpg)









![SK매직, ‘초소형 라이트 직수 정수기’⋯“크기 줄이고 공간 효율 높이고” [새봄 새출발]](https://img.etoday.co.kr/crop/85/60/2298646.jpg)
!["다같이 단종 안아"⋯'왕사남', 과몰입 비결 탈탈 털어보니 [엔터로그]](https://img.etoday.co.kr/crop/300/170/2299262.jpg)
![국민의힘, 상법 개정안 필리버스터 '돌입' [포토]](https://img.etoday.co.kr/crop/300/190/2299313.jpg)