국내에서 지속성 성장호르몬의 개발을 진행하고 있는 회사로 제넥신, 한미약품, 알테오젠을 꼽을 수 있다. 지속형 성장호르몬에 관심이 높은 것은 국내 뿐만이 아니다. 올해 초 선발주자였던 화이자-옵코의 지속성 성장호르몬이 임상 3상에서 실패하면서 지속성을 높인 2세대 성장호르몬 시장을 선점하기 위한 경쟁이 더욱 치열해지고 있다. 국내 기업을 포함해 Versatis, Ascendis, Novo Nordisk 등이 임상을 진행 중이다.
이러한 상황에 안국약품도 경쟁대열에 끼어들었다. 이들 기업의 기술플랫폼과는 다른 접근방법의 지속성 성장호르몬 치료제 'AG-B1512'를 통해서다. 해당 약물은 지난 4일 한국보건산업진흥원의 ‘신약개발 비임상·임상시험 지원과제’에 선정돼 향후 2년간 총 17억6000만원의 연구비 중 10억5000만원을 지원받는다는 소식이 전해지면서 이목을 끌었다.
AG-B1512는 현재 전임상 GLP 독성시험을 진행하고 있으며, 안국약품에 따르면 내년 미국식품의약국(FDA)에 임상시험 승인을 신청(IND filing)할 예정이다. 국내 경쟁사로 제넥신과 한미약품이 글로벌 임상2상을 진행하고 있고, 알테오젠이 최근 국내 임상2상을 승인받은 것과 비교하면 다소 늦은 진행이다.
그럼에도 불구하고 안국약품이 진행하는 지속성 성장호르몬 치료제에 눈길이 가는 이유는 SAFA(Anti Serum Albumin Fab Associated)라는 독특한 지속성 기술 때문이다. 안국약품은 성장호르몬 이외에도 SAFA기술이 적용된 지속형 호중구감소증 치료제 'AG-B1511'도 진행하고 있다. 두 파이프라인은 현재 안국약품이 공개한 유일한 바이오신약으로, 회사에 따르면 2019년에 기술이전하는 것을 목표로 한다.
여기서 궁금증이 생긴다. SAFA 기술은 어떤 작용기전을 가지고 있고, 기술력에 근거한 향후 경쟁력은 어느정도일까? 아직 개발 초기단계지만 안국약품이 올해 ENDO에서 발표한 포스타자료를 참고해 향후 지속성 성장호르몬제가 가진 가능성을 확인해 봤다.
안국약품이 에이프릴바이오로부터 들여온 지속형 치료제의 기반 'SAFA' 기술은?
안국약품이 두개의 지속형 치료제를 시작하게 된 경위는 2015년에 에이프릴바이오로부터 SAFA 기술이 적용된 파이프라인을 인수하면서 시작했다. 에이프릴바이오는 2013년 차상훈 교수가 강원대학교 학내 바이오벤처로 시작한 기업이다. 에이프릴바이오의 핵심기술 중 하나가 지속형 SAFA 기술로 국내에 특허등록, 해외 42개국에 특허출원을 한 상태다. 이외에도 회사는 인터페론1a, 여포자극 호르몬, 인슐린에 대한 지속성약물 및 이중항체 기술을 연구하고 있다.
지속성 기술은 기존의 약물이 체내에서 더 오래 머물도록 하는 개념이다. 의사가 하루에 한번 투여해야 되는 성장호르몬을 지속성 기술로 1주, 혹은 한달에 한번 투여해도 같은 효능을 기대할 수 있는 것이다. 크게 생분해성 물질을 이용해 약물을 서서히 방출하는 지속형방출(SR) 기술, 그리고 약물을 일부 변형해 체내 반감기를 늘리는 두가지 접근방법이 있다. 안국약품을 포함한 국내 지속성 성장호르몬 기술은 모두 후자에 속한다.
SAFA 기술은 크게 세 부분으로 나뉜다. 혈청 알부민(serum albumin)에 결합하는 항체의 항체결합절편(Fab), 약물(성장호르몬), 그리고 이를 이어주는 아미노산 서열이다. 일반적으로 지속성 기술에서 알부민이 붙으면 전체 분자 크기가 증가해 신장에서 걸려져 배출되는 것을 막는다. 밖으로 덜 내보냄으로써 체내 반감기를 늘리는 원리다.
반면 항체절편을 붙이는 경우는 항체가 가진 우수한 체내반감기를 이용한다. 항체는 혈액 내 체내반감기가 21일(IgG3 제외)로, 성장 호르몬의 반감기가 4시간이라는 것을 고려하면 매우 안정적인 물질임을 짐작할 수 있다. IgG가 긴 반감기를 가지는 이유 중 하나는 세포속으로 들어가 분해되지 않고 다시 나오는 기전이 있기 때문이다. 그리고 이러한 작용을 매개하는 것이 세포표면에서 IgG와 결합하는 수용체인 ‘FcRn(neonatal Fc receptor)’다.
그런데 SAFA 기술에서는 항체에서 FcRn을 매개하는 부분이 아닌 항원에 결합하는 Fab 절편을 이용한다. 흥미롭게도 체내에 들어가면 Fab에 알부민이 결합하고, 알부민이 FcRn과 상호작용해 세포안으로 들어가 분해되지 않고 다시 세포밖으로 방출되는 원리다.
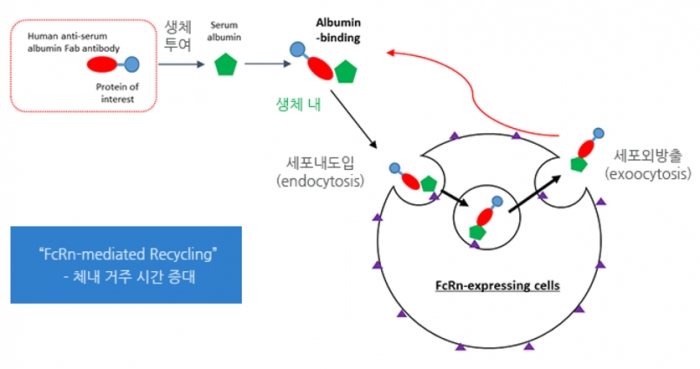
작용기전은 IgG를 붙인 것과 유사하지만, Fab는 약 50kDa의 크기를 가지기 때문에 상대적으로 분자량이 작다. 또한 알부민에 강한 결합력을 가진 Fab를 선택해 체내에서 자연적으로 결합되도록 유도했다. 때문에 알부민과 항체부위를 인공적으로 합성해 결합할 필요가 없다. 일반적으로 지속성을 증가시키기 위해 두가지 이상의 기술이 들어갈 경우 균일한 생산이 어려워 제품의 품질관리(QC)가 떨어질 수 있는 가능성이 있다.
안국약품 관계자는 "동물세포가 아닌 대장균(E. coli)의 단백질생산 시스템을 활용해 생산하기 때문에 생산효율이 높다"며 "정제과정이 총 3가지 스텝으로 상대적으로 용이해 경쟁사에 비해 가격경쟁력이 있다"고 설명했다.
AG-B1512, 전임상 데이터에서 보여주는 약물지속성은?
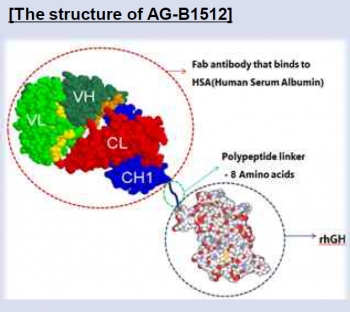
AG-B1512는 anti-HSA(인간혈청 알부민) Fab가 8개의 아미노산으로 구성된 폴리펩타이드 링커(linker)를 통해 성장호르몬과 연결된 재조합단백질이다.
안국약품은 쥐, 원숭이에서 AG-B1512의 단일투여에 따른 약물의 약동력학적(PK/PD) 특징과 생체이용률(bioavailability) 데이터를 공개했다. 이 결과 중, 인간에서 지속성약물의 약동력학적 특징을 유사하게 대변한다고 알려진 원숭이에서의 실험결과를 중점적으로 살펴봤다.
안국약품은 원숭이에 2.5mg/kg 정맥주사(iv), 2.5mg/kg 피하주사(sc), 7.5mg/kg 피하주사로 3그룹(각 n=3)으로 나눠 AG-B1512를 투여했으며, 성장호르몬의 지속성을 평가하기 위해 24일까지 혈청내 성장호르몬의 농도를 확인했다. 성장 호르몬에 의해 분비가 촉진되는 혈청내 IGF-1(insulin-like growth factor-I) 농도를 확인했다. IGF-1은 성장호르몬 주입에 따른 주 대사산물로 임상적인 효능을 확인하는 바이오마커로 이용된다.
대조군으로 투여된 약물은 1일 제제인 화이자의 지노트로핀(genotropin)이다. 일반적으로 인간에는 원숭이에 투여량의 2배 정도를 주입한다고 알려져 있다.
AG-B1512의 혈액 내 반감기(T1/2)는 2.5mg/kg 정맥주사, 2.5mg/kg 피하주사, 7.5mg/kg 피하주사 그룹에서 33.3, 97.7, 197시간이다. 197시간을 계산하면 7.5mg/kg을 주사했을 때 약 8일 정도의 반감기를 가진다. 약물의 혈액 내 IGF-1 수준을 확인했을 때 약물주입 후 20일 정도에 다시 원래(baseline)의 IGF-1 농도로 돌아온다는 설명이다. 올라간 IGF-1 레벨을 나타내는 그래프가 다시 X축과 만나는 지점을 통해 약효 지속기간을 확인할 수 있다. 단 AG-B1512 투여한 약물의 혈중농도가 7일을 지나면서 감소변화가 크다는 것을 알 수 있다. (오른쪽 그래프).
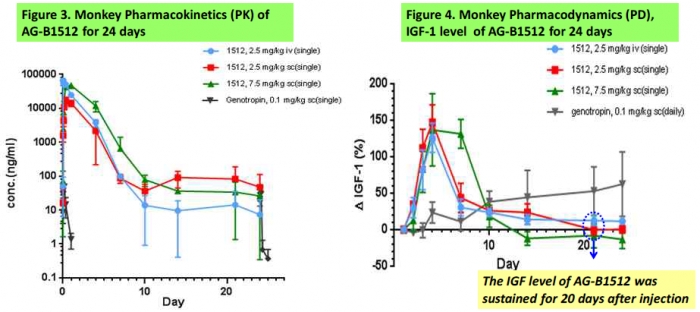
안국약품은 "우리의 지속성 약물을 피하주사 형태로 원숭이에 주입했을 때 농도에 따라 혈중약물 농도의 곡선하면적(AUC)이 증가한 것을 확인했다"며 "이를 통해 계산된 AG-B1512의 생체이용률(bioavailability) 47.1%로 나타났다"고 설명했다. 안국약품은 AG-B1512가 향후 환자에서 한달에 1회 혹은 2회 투여되는 제품으로 개발될 수 있음을 제시했다. 다만 기존의 1일 제제와 유사한 효능을 기대하기 위해서는 7일 이후의 시점에서 약물의 안정성을 높이는 방안이 보완돼야 할 것으로 보인다.
한편, 지난해 글로벌 성장호르몬 시장규모는 약 39억6000만 달러(약 4조원)으로 매년 4%의 성장률을 가진다. 1일 제제 성장호르몬 치료제 시장은 노보노디스크(31%), 화이자(20%), 일라이릴리(8%), 산도즈(8%), 머크세르노(8%)가 차지하고 있다. 그럼에도 불구하고 아직까지 상업적으로 성공한 지속형 성장 호르몬은 없다. 지속형 제제에 대한 미충족 욕구에 대한 수요가 높기 때문에 2세대 지속형 성장호르몬에 대한 수요는 계속적으로 증가할 것으로 예측된다. Versartis, Ascendis, Novo Nordisk, 제넥신 등이 약물개발에 도전하는 이유다.
이전 글로벌 파마가 지속형 호르몬 치료제 개발을 시도했으나 임상에서 번번이 실패했다. 대규모 생산의 어려움, 부작용, 뇌에서 지속성을 위해 변형한 페길화(pegylation) 부위의 축적, 약물에 대한 항체형성(ADA, anti-drug antibody), 농도의존적 약물효능입증 실패 등이 주요원인이었다.



![직장인 설 상여금, 10명 중 4명은 받는다 [데이터클립]](https://img.etoday.co.kr/crop/140/88/2294169.jpg)








!["엔비디아가 골목길 입구까지 쫓아왔다?" 자율주행 사이다 팩트 체크 [찐코노미] #테슬라](https://i.ytimg.com/vi/tIWc3d9GgOE/mqdefault.jpg)









![직장인 설 상여금, 10명 중 4명은 받는다 [데이터클립]](https://img.etoday.co.kr/crop/300/170/2294169.jpg)
![국회 본회의 ,경제분야 대정부 질문 [포토]](https://img.etoday.co.kr/crop/300/190/2294216.jpg)