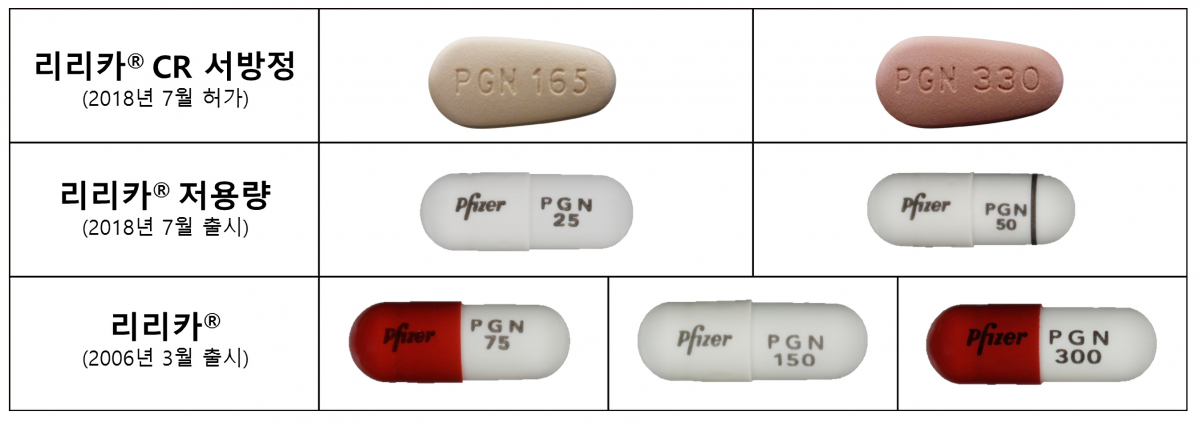
한국화이자제약의 신경병증성 통증치료제 ‘리리카’가 프레가발린 성분 서방정 제제 가운데 처음으로 국내 판매 허가를 받았다.
한국화이자제약은 지난 18일 식품의약품안전처로부터 서방정 82.5mg과 165mg, 330mg에 대한 판매 허가를 받았다고 24일 밝혔다. 이에 따라 리리카는 지난 1일 출시한 25mg, 50mg 저용량 제제와 더불어 새롭게 허가 받은 CR서방정 제제에 이르기까지 신경병증성 통증 치료에 있어서 다양한 치료옵션을 갖추게 됐다.
‘리리카CR서방정’은 성인 말초 신경병증성 통증의 치료에 사용 가능하며, 165mg과 330mg 두 가지 용량으로 출시된다. 기존 리리카 캡슐의 1일 2회 복용법을 1일 1회로 줄임으로써 환자의 복약 편의성과 복약 순응도를 높일 것으로 기대를 모은다. 이 약은 지난해 10월 미국 식품의약국(FDA)으로부터 당뇨병성 말초 신경병증과 연관된 신경병증 통증 관리 및 대상포진 후 신경통 관리를 위한 치료제로 미국 내 판매 승인을 받았다.
오동욱 한국화이자제약 대표는 “리리카는 탄탄한 의학적 근거를 토대로 신뢰를 쌓은 오리지널 프레가발린 제제”라며 “앞으로도 신경병증성 통증 치료제 분야에서 환자들의 치료 향상과 삶의 질 개선을 위해 지속적으로 노력할 것”이라고 말했다.
한편 리리카는 섬유근육통 치료제로서 타임지가 선정한 '올해의 10대 의학 혁신'으로 선정된 바 있다. 또한, 미국 당뇨병학회 등이 발표한 당뇨병성 신경병증 통증치료 가이드라인에서 1차 치료제로 우선 권고받았다.


![한국 첫 메달은 스노보드 김상겸…오늘(9일)의 주요일정 [2026 동계올림픽]](https://img.etoday.co.kr/crop/140/88/2293019.jpg)
![[단독] 신용보증기금, 전사 AI 통합 플랫폼 만든다⋯‘금융 AX’ 모델 제시](https://img.etoday.co.kr/crop/140/88/2292951.jpg)
![강남권 매물 늘었는데⋯고위공직자 선택 주목 [고위공직 다주택자 시험대①]](https://img.etoday.co.kr/crop/140/88/2292959.jpg)
![[날씨] 월요일 출근길 체감온도 '영하 15도'…강추위 낮부터 풀린다](https://img.etoday.co.kr/crop/140/88/2292831.jpg)
!['김건희 집사' 김예성 선고...'삼성전자 특허 유출' 안승호 전 부사장 1심 결론 [이주의 재판]](https://img.etoday.co.kr/crop/140/88/2229916.jpg)
![[주간수급리포트] 외국인과 맞붙은 개미…삼전·SK하닉 선택 결과는?](https://img.etoday.co.kr/crop/140/88/2292971.jpg)










![‘차이나 런’의 부메랑…핵심광물 ‘보복성 통제’ 대응책은 [탈중국 비용 청구서]](https://img.etoday.co.kr/crop/85/60/2292949.jpg)
![“AI 칩 하나에 광물 100종”…포지發 반도체 원가 변동 [탈중국 비용 청구서]](https://img.etoday.co.kr/crop/85/60/2292937.jpg)

![‘의장국 프리미엄’ vs ‘차이나 리스크’…공급망 핸들 잡은 韓 ‘외줄타기’ [탈중국 비용 청구서]](https://img.etoday.co.kr/crop/85/60/2292968.jpg)
![글로벌 주목받는 K-미용 의료기기…해외 매출↑[잘 나가는 K-더마뷰티②]](https://img.etoday.co.kr/crop/85/60/2292898.jpg)
![2월 첫째 주 유튜브 영상 순위 [이투PICK 순삭랭킹]](https://img.etoday.co.kr/crop/300/170/2278370.jpg)
!['주유소 기름값 9주 연속 하락세' [포토로그]](https://img.etoday.co.kr/crop/300/190/2292925.jpg)