중국에서 의약품 안전 문제가 잇따라 발생하자, 국제사회의 우려가 커지고 있다. 파이낸셜타임스(FT)는 6일(현지시간) 최근 의약품 안전 문제와 관련해 중국 정부의 관리 체계에 대한 문제가 부각되고 있다고 보도했다. 첨단의약업은 중국 정부가 ‘중국제조 2025’의 10대 중점 산업에 넣을 정도로 공을 들이는 분야다.
영국 의약품 규제 당국에 따르면 중국은 전 세계 활성원료(API) 생산량의 40%를 차지한다. API는 의약품을 만들기 위한 원료이다. 지난해 중국의 API 수출액은 290억 달러(약 32조6656억 원)에 달했다. 존슨앤존슨과 노바티스 등 다국적 제약회사도 중국산 API를 사용하고 있다. 업계는 미국에서 사용되는 API의 80%가 중국과 인도에서 생산되는 것으로 추정하고 있다.
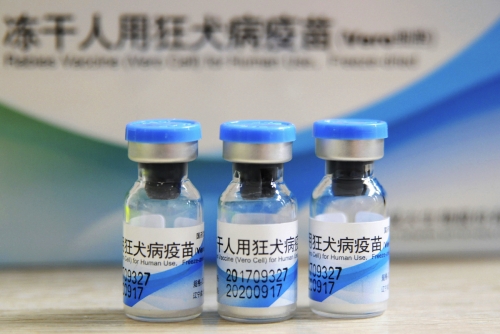
그러나 지난달 안전 문제가 연달아 불거지면서 중국 의약업계는 신뢰에 큰 타격을 입었다. 절강화해제약이 생산한 발사르탄 API에서 발암성 불순물인 N-니트로소디메틸아민(NDMA)이 검출되면서 한국과 유럽 등지에서 고혈압 치료제 판매를 잠정 중지하는 등 한바탕 소동을 겪었다. 이어 창성바이오가 기준 미달인 인체용 광견병 백신과 어린이용 DPT(디프테리아·백일해·파상풍) 백신을 생산했다는 사실이 드러나면서 논란은 커졌다.
문제는 중국의 수출 전문 제약기업은 규제 당국의 조사를 받을 필요가 없어 감시 체계에 구멍이 뚫렸다는 점이다. 업체들은 자체 조사를 시행한 후 미국 식품의약처(FDA)나 유럽의약품안전청(EMA)에 위반 사항을 자진 신고하게 돼 있다. 컨설팅회사인 언스트앤영(EY)의 존 린 파트너는 “많은 중국 API 제조업체들이 제조 공정을 엄격하게 따르지 않으며 데이터도 기록하지 않는다”고 지적했다. 이어 “규제 당국은 직원이 부족해 현장을 제대로 감시하지 못한다”고 설명했다.
FDA와 EMA가 중국 제약 업체를 조사하고 있지만, 인력 부족이 걸림돌이다. 지난해 FDA의 수입 블랙리스트에 오른 기업은 22곳으로 2014년 5곳보다 크게 늘었다. EMA와 FDA는 수십 곳의 API 제조업체에 의약품 제조 기록 규정을 위반했다는 경고 서한을 보냈다. 그러나 중국 전역의 700개 공장을 감시하는 FDA 직원이 22명에 불과한 데다 사전 예고 후 조사를 해 실효성에 의문이 제기되고 있다. 미국 약무전문가협회(RAPS)는 “미 의회는 FDA가 API 공급망을 제대로 감시할 수 있을지 우려하고 있다”고 전했다.
중국은 첨단 의약 분야를 세계적인 수준으로 끌어올리기 위해 관리 감독을 강화했다. 2015년 중국 식품의약처는 선진국 수준의 규제를 도입했고 지난해 국제의약품규제조화위원회(ICH)의 8번째 회원국이 됐다. 규정에 따라 당국은 제약 회사를 무작위로 조사해 작년에만 32개 회사의 제조 인증을 박탈했다. 그러나 여전히 지방 관리들은 소규모 생산 업체들의 기준 미달을 눈감아주고 있으며 감시관의 봉급이 적어 뇌물 수수가 잦다. 데이비드 디어 파이자바이오 최고영업책임자(CCO)는 “모든 규정이 서류 상에만 있다”며 “이제는 실행해야 할 때”라고 조언했다.
보건 분야 싱크탱크인 헤이스팅스센터의 로즈마리 깁슨 고문은 “제약 산업의 비용 절감이 기준 미달 제품을 만든 원인”이라며 “세계화는 사실상의 규제 완화”라고 꼬집었다.


![신동빈 롯데회장, '첫 금메달' 최가온에 축하 선물 [2026 동계 올림픽]](https://img.etoday.co.kr/crop/140/88/2295821.jpg)



















![2월 둘째 주 유튜브 영상 순위 [이투PICK 순삭랭킹]](https://img.etoday.co.kr/crop/300/170/2278370.jpg)
![설날, 분주한 김포공항 '북적' [포토]](https://img.etoday.co.kr/crop/300/190/2296440.jpg)