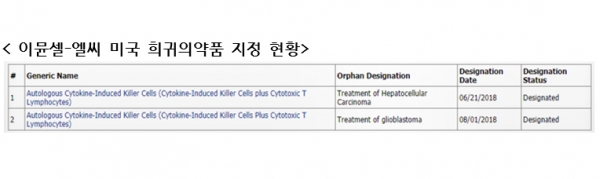
GC녹십자셀의 세포치료제 이뮨셀-엘씨가 미국 식품의약국(FDA)로부터 간암과 뇌종양 적응증에 대한 희귀의약품 지정을 받았다.
GC녹십자셀은 미국 식품의약국(FDA)으로부터 이뮨셀-엘씨에 대한 뇌종양(교모세포종) 희귀의약품 지정을 승인 받았다고 17일 밝혔다. 지난 6월 미국 식품의약국(FDA)에서 간암에 대한 희귀의약품으로 지정된 데 이어 두번째다.
‘이뮨셀-엘씨’는 환자 자신의 혈액을 원료로 만드는 환자 개인별 맞춤항암제로, 약 2주간의 특수한 배양과정을 통해 항암기능이 극대화된 강력한 면역세포로 제조해 환자에게 투여한다. 이뮨셀-엘씨는 국내에서 2007년 간암에 대한 항암제로 식품의약품안전처의 품목허가를 획득해 생산, 판매하고 있다.
FDA의 희귀의약품 지정(ODD, Orphan Drug Designation)은 희귀난치성 질병 또는 생명을 위협하는 질병의 치료제 개발 및 허가가 원활하게 이뤄질 수 있도록 지원하는 제도이다. 희귀의약품으로 지정된 치료제는 세금 감면, 신약승인 심사비용 면제, 시판허가 승인 후 7년간 독점권 인정 등 다양한 혜택이 부여된다.
GC녹십자셀은 이번 희귀의약품 지정을 계기로 미국 시장 진출을 위한 전략을 구상 중이다. 현재 FDA에 추가적으로 췌장암에 대한 희귀의약품 지정도 신청해 그 결과를 기다리고 있다.
GC녹십자셀의 이득주 사장은 “국내에서 이미 대규모 임상시험이나 연구자 임상시험을 통해 효과를 입증한 간암, 뇌종양(교모세포종), 췌장암에 대해 우선적으로 FDA에 희귀의약품 신청을 했고 긍정적인 결과를 얻었다. 미국 내 임상시험을 최소화해 비용과 시간을 절약하고 성공적으로 미국 시장에 진출하기 위한 전략을 구상 중"이라고 설명했다.
GC녹십자셀은 셀 센터(Cell center) 신축을 통해 매출이 급격히 증가하고 있는 이뮨셀-엘씨 생산시설 확충 및 차세대 세포치료제 CAR-T 등 신제품 개발을 위한 인프라 구축과 세포치료제 글로벌 진출을 위한 성장동력을 확보하고 있다. 셀 센터는 2019년 말 GMP인증을 목표로 하고 있다.
GC녹십자셀은 이뮨셀-엘씨 외에도 차세대 세포치료제 ‘CAR-T(Chimeric Antigen Receptor T cell)’를 개발하고 있다. CAR-T는 환자의 T세포를 체외에서 조작해 암세포 표면의 특정 단백질 항원을 인식하는 CAR를 면역세포 표면에서 생성하도록 만든 뒤 다시 환자에게 주입해 일종의 유도탄처럼 암세포만을 정확하게 공격하는 면역세포치료제이다.

![[종합] 다우지수 사상 최고치…뉴욕증시, 월가 출신 재무장관 지명에 환호](https://img.etoday.co.kr/crop/140/88/2106795.jpg)
![[날씨] 제주 시간당 30㎜ 겨울비…일부 지역은 강풍 동반한 눈 소식](https://img.etoday.co.kr/crop/140/88/2106722.jpg)




!["여보! 부모님 폰에 ‘여신거래 안심차단’ 서비스 해드려야겠어요" [경제한줌]](https://img.etoday.co.kr/crop/140/88/2106598.jpg)
![갖고 싶은 생애 첫차 물어보니…"1000만 원대 SUV 원해요" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2106641.jpg)



![테슬라 능가하는 엄청난 것이 나온다? 머스크가 일으킬 파란과 운명 ㅣ 강정수 박사 [찐코노미]](https://i.ytimg.com/vi/kmly6gVHIMU/mqdefault.jpg)




!['비용절감'의 시대…K배터리가 리튬 수급처 늘리는 이유 [모빌리티]](https://img.etoday.co.kr/crop/85/60/2106773.jpg)

![韓 시장 노리는 BYD 씰·아토3·돌핀 만나보니…국내 모델 대항마 가능할까 [모빌리티]](https://img.etoday.co.kr/crop/85/60/2106689.jpg)



![[찐코노미] 테슬라 능가하는 엄청난 것이 온다?…머스크가 일으킬 파란은](https://img.etoday.co.kr/crop/300/170/2106712.jpg)
![국회 예결위 예산안등조정소위 [포토]](https://img.etoday.co.kr/crop/300/190/2107120.jpg)