셀트리온이 미국과 유럽에서 개최된 주요 학회에서 자가면역질환 치료용 항체 바이오시밀러 램시마 피하주사(SC) 제형에 대한 임상 1/3상 파트1 연구 결과를 발표했다.
셀트리온은 23일(현지시간) 오스트리아 빈에서 개최된 유럽장질환학회와 미국 시카고에서 열린 미국류마티스 학회에서 활성 류마티스관절염 환자와 활성 크론병 환자 대상 램시마의 피하주사 제형과 정맥주사(IV) 제형 간 약동학, 면역원성, 유효성 및 안전성을 비교한 임상 연구 결과를 발표했다.
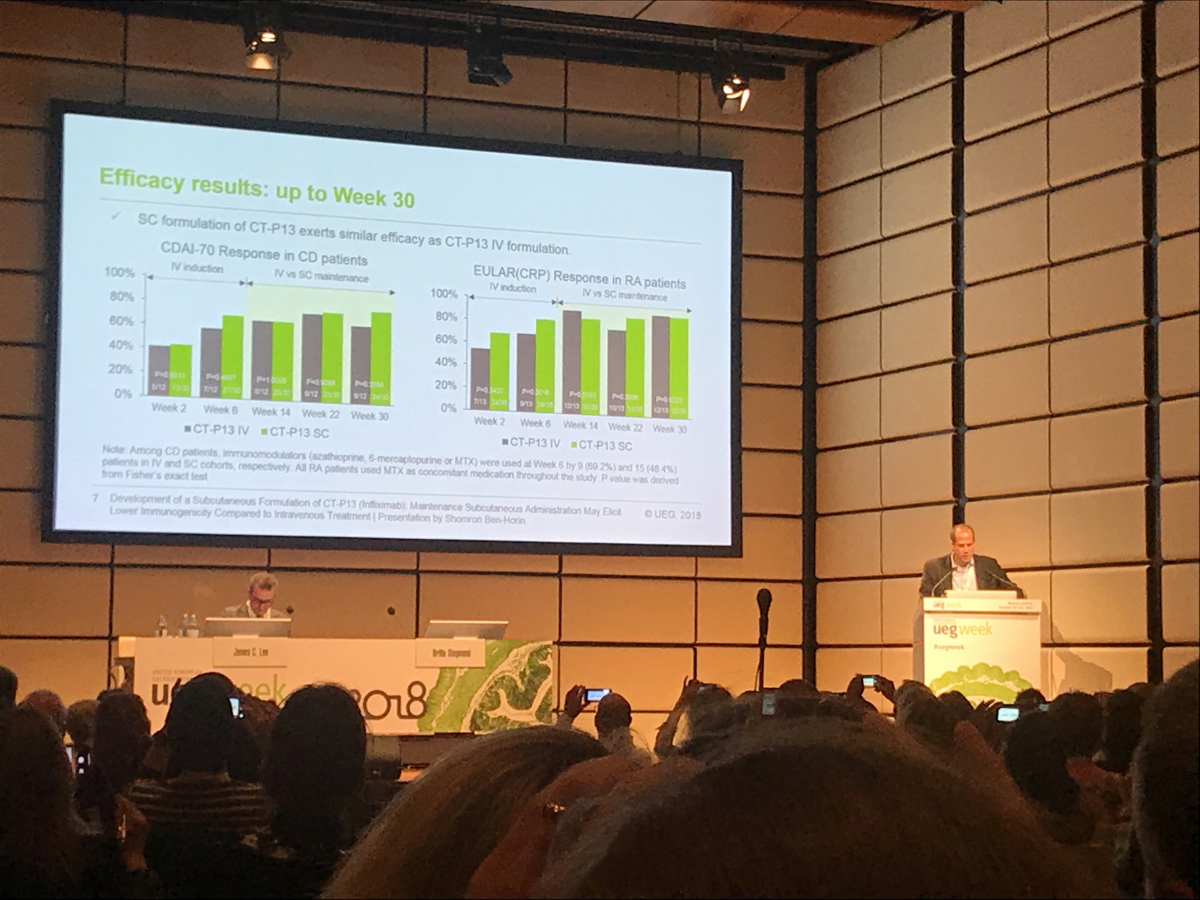
임상에서 연구진은 활성 류마티스 관절염 환자와 활성 크론병 환자를 각각 램시마 IV 투여유지 군, 램시마 SC 투여유지 군으로 나눠 첫 투여 시와 치료 2주차에 모든 환자에게 램시마 IV를 투여했다. 이후 6주차부터 램시마 IV 투여유지군에는 8주 간격으로 램시마 IV를, 램시마 SC 투여유지군에는 격주로 램시마 SC 약물을 투여하며 총 54주간 각 군별 약동학, 면역원성, 유효성 및 안전성 등을 평가했다.
그 결과 격주로 램시마 SC를 투여한 군의 체내 약물 농도는 8주 간격으로 램시마 IV를 투여한 군에 비해 안정적으로 유지됐다. 안전성 평가 결과에서 양 군의 데이터는 동등한 수준으로 나타났다.
유럽장질환학회 구술발표에서 램시마 SC 임상 연구 발표 연자로 나선 이스라엘 텔아비브 대학 셰바 메디컬센터의 숌론 벤 호린 교수는 “이번 임상에서 램시마 IV제형과 SC 제형 간 유효성 및 안전성 결과가 유사함을 확인했다”며 “램시마 SC는 세계 의료진과 환자들에게 IV 인플릭시맵의 매력적인 치료 대안으로서의 가능성을 보여줬다”고 말했다.
셀트리온 관계자는 “셀트리온은 램시마 SC의 임상 진행과 병행해 유럽 허가 신청을 준비해 왔으며, 최근 허가 준비 마무리 단계에 돌입했다”며 “램시마 SC가 상업화 되면 환자 상태와 편의를 고려해 단일한 인플릭시맵 성분 약품을 정맥주사 또는 피하주사로 자유롭게 선택해 처방할 수 있을 것으로 기대된다”고 밝혔다.






![포켓몬, 아직도 '피카츄'만 아세요? [솔드아웃]](https://img.etoday.co.kr/crop/140/88/2296074.jpg)














![[BioS]광동제약, 국내판권 보유 '노안 치료제' FDA 승인](https://img.etoday.co.kr/crop/85/60/2227282.jpg)

![최가온, 韓 첫 설상 금메달… ‘마지막 3차 런’ 승부수 통했다 [이슈크래커]](https://img.etoday.co.kr/crop/300/170/2295821.jpg)
!['날 풀리니 전국 초미세먼지 말썽' [포토로그]](https://img.etoday.co.kr/crop/300/190/2296140.jpg)