GMP는 소비자 보호를 위해 제조소의 구조•설비를 비롯하여 원자재의 구입에서부터 제조•포장•보관 및 출하에 이르기까지의 전 공정에 대한 철저한 제조관리와 품질관리를 시행함으로써 우수 품질의 의료기기를 생산•공급하도록 하는 품질관리 기준이다. 국내의 모든 체외진단용 의료기기가 품질 적합성을 증명하기 위해서는 식약처로부터 의무적으로 획득해야만 한다.
마크로젠은 이번 GMP 인정 획득을 통해 제조시설 보유와 체외진단용 시약 제품을 자체 생산하고 직접 판매할 수 있는 자격을 획득, 국내 암 진단시약 사업의 첫 발판을 마련했다.
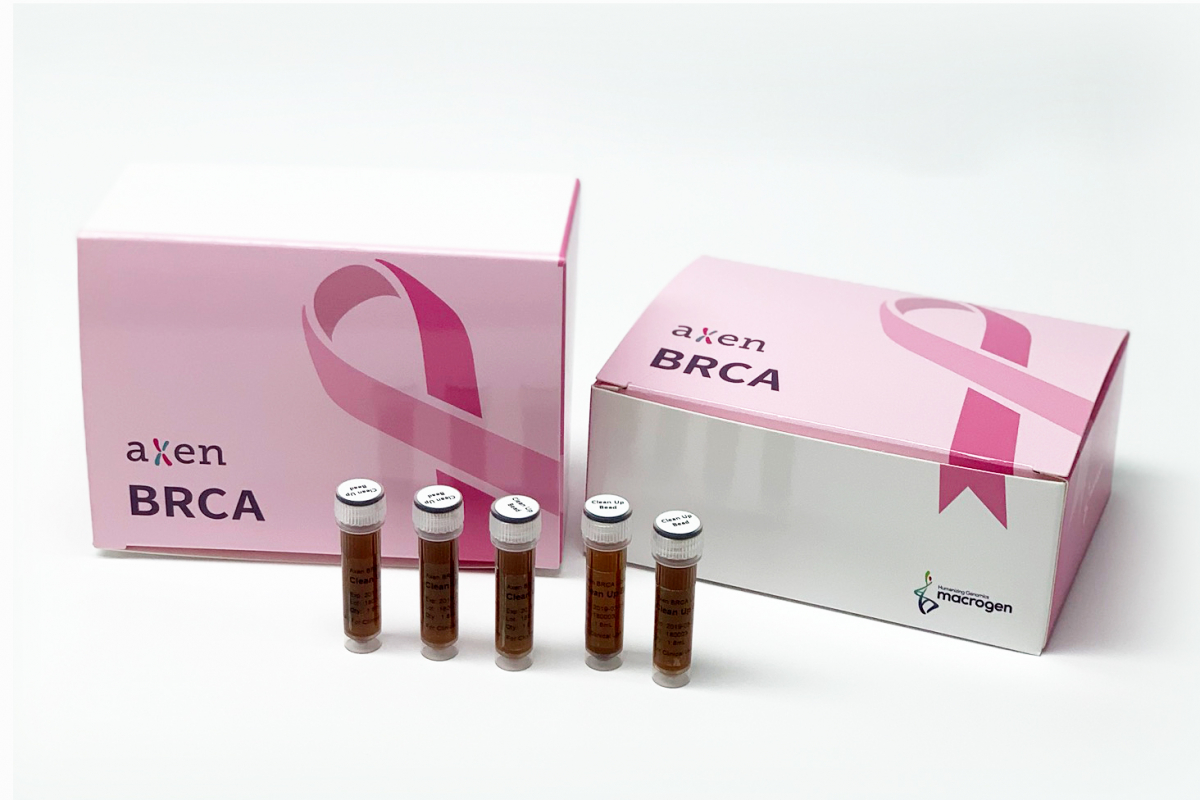
이번에 마크로젠이 인정 받은 시약 제품은 유방암의 원인 유전자 BRCA1, BRCA2를 해독할 수 있는NGS(차세대 염기서열 분석법) 기반의 유방암 진단시약 제품으로 제품명은 ‘악센 브라카 라이브러리 키트(Axen BRCA Library Kit)’다. 해당 시약은 의료진이 일반 환자의 유전적 정보를 확인해 유방암 진단 및 처방 계획을 세우기 위한 과정에 활용된다. 이 제품은 향후 임상시험과 시판 승인 과정을 거쳐 시장에 출시될 예정이다.
마크로젠은 먼저 유전적 요인에 의한 유병률이 높은 유방암을 타깃으로 지난해 시약 개발을 완료했으며, 이어 폐암 등 전체 암종으로 대상을 확대해 관련 제품을 지속적으로 선보일 계획이다.
양갑석 대표는 “마크로젠은 유방암 진단시약 외에도 다양한 종류의 암 진단시약을 차례로 개발할 예정이며, 특히 높은 정확도와 획기적인 가격 경쟁력을 무기로 국내외 암 진단시약 시장을 적극 공략할 계획”이라고 말했다.


![[단독] 한국피자헛 ‘새 주인’에 케이클라비스인베·윈터골드PE](https://img.etoday.co.kr/crop/140/88/2293889.jpg)
![연휴 앞둔 인천공항이 불안한 이유 [해시태그]](https://img.etoday.co.kr/crop/140/88/2295544.jpg)









![전기차 다음은 로봇…배터리업계, 휴머노이드로 확장 [캐즘後, 배터리 선택은]](https://img.etoday.co.kr/crop/85/60/2295705.jpg)
![전기차 둔화에 동맹 균열…JV 접는 배터리, ESS로 새판 짜기 [캐즘後, 배터리 선택은]](https://img.etoday.co.kr/crop/85/60/2295704.jpg)


![[BioS]뷰노, 100억 규모 ‘영구 CB’ 발행 결정](https://img.etoday.co.kr/crop/85/60/2004178.jpg)
![“달달함에 꽂힌 MZ·외국인 잡는다”...성수동 ‘CU 디저트 특화점포’[가보니]](https://img.etoday.co.kr/crop/85/60/2295706.jpg)




![명절 최대 고민은…男 '양가 일정 조율'·女 '지출 부담' [데이터클립]](https://img.etoday.co.kr/crop/300/170/2295553.jpg)
![북적이는 인천공항…설 연휴, 122만명 몰린다 [포토로그]](https://img.etoday.co.kr/crop/300/190/2295638.jpg)