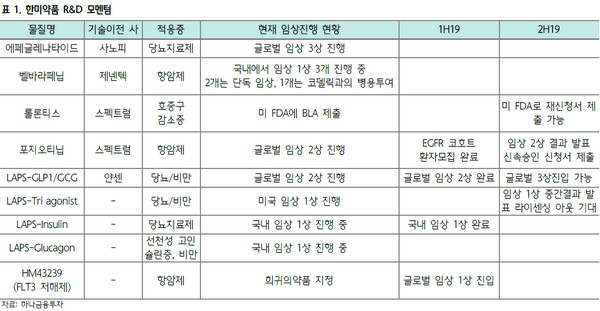
하나금융투자 선민정 연구원은 “FDA가 요구한 데이터 보완은 대부분 미국 현지에서 생산한 완제와 관련된 건으로 롤론티스의 원료는 한미약품이 생산하고, 이 원료를 이용한 완제는 스펙트럼으로부터 위탁받은 미국 내 CMO 업체가 생산하고 있기 때문에 FDA의 데이터 보완은 한미약품이 아니라 미국 내 CMO 업체와 관련된 건으로 볼 수 있다”며 “이로 인한 스펙트럼사의 주가는 3% 정도 하락에 불과했으며, 완제 생산을 담당하는 현지 CMO의 문제로 전임상이나 임상에 대한 추가 데이터를 요청한 것은 아니기 때문에 3~4개월 뒤 다시 재신청서 제출이 가능할 것으로 기대된다”고 말했다. 또 시판허가는 애초 예상했던 올해 말보다 다소 늦어진 2020년 상반기로 예상했다.
선 연구원은 “롤론티스의 허가신청 자진 취하로 하반기 한미약품의 R&D 모멘텀 중 하나인 롤론티스 시판허가 이슈는 올해 말이 아니라 내년 초로 다소 연기됐지만, 그 외의 R&D 모멘텀은 여전히 견고하다”며 “스펙트럼사가 개발하고 있는 또 다른 파이프라인인 포지오티닙의 경우 올해 1월 EGFR Exon 20 돌연변이 환자들을 대상으로 한 임상 2상의 환자 모집을 완료, 하반기 임상 2상 결과를 발표할 수 있을 것으로 기대된다”고 밝혔다.
그는 “3분기 얀센이 개발 중인 LAPS-GLP1/GCG 임상 3상 진입 및 LAPS-Triple agonist의 임상 1상 중간결과 발표 이후 라이센싱 아웃 기대감 등 한미약품이 보유한 파이프라인들의 R&D 성과가 예정돼 있다”며 “특히 LAPS-GLP1/GCG가 임상 3상에 진입할 경우 임상 2상의 성공확률 23.8%에서 3상 성공확률이 62.4%로 크게 증가하면서 LAPS-GLP1/GCG의 가치는 약 1.6조 원 정도 증가할 것으로 기대된다”고 덧붙였다.























![키키도 소환한 그 감성⋯Y2K, 왜 아직도 먹히냐면요 [솔드아웃]](https://img.etoday.co.kr/crop/300/170/2292619.jpg)
!['주유소 기름값 9주 연속 하락세' [포토로그]](https://img.etoday.co.kr/crop/300/190/2292925.jpg)