셀트리온이 개발한 인플릭시맙 피하주사제형 '램시마SC’가 염증성 장질환(IBD)에서 기존 정맥주사제형(IV)과 폭넓게 교체처방(스위칭)이 가능함을 확인했다. 지난해 10월 발표한 6주 후 뿐 아니라 이번 30주 후 교체처방(IV→SC) 모두에서 기존 치료제와 동등한 유효성과 안전성을 입증했다.
18일 셀트리온에 따르면 숌론 벤 호린(Shomron Ben-Horin) 이스라엘 텔아비브대학 교수는 최근 열린 ‘제15회 유럽 크론병 및 대장염학회(ECCO)’에서 크론병(CD) 및 궤양성 대장염(UC) 환자 대상 54주(1년) 임상에서 램시마SC의 유효성, 약동학적 특성(PK), 안전성 등을 확인한 결과를 발표했다.
이번 임상은 크론병 및 궤양성 대장염 환자 131명을 대상으로 램시마IV에서 램시마SC로 교체투여해도 치료효과와 안전성에 문제가 없음을 확인하기 위한 것이다.
임상은 한국(서울아산병원)을 포함해 이스라엘, 폴란드, 오스트리아, 독일 등에서 수행됐으며 연구진은 임상에 등록된 환자를 2개군으로 나누어 진행했다. 모든 환자는 치료 0주차, 2주차에 램시마IV 5mg/kg을 투여받았다. 이후 6주차부터 램시마SC로 교체 투여받은 환자군(66명, CD: 28명/ UC: 38명)과 IV를 계속 투여받는 환자군(65명, CD: 25명/ UC: 40명)으로 나뉘었다.
이때 램시마SC는 120mg(80kg 미만 환자) 또는 240mg(80kg 이상 환자) 용량으로 2주마다 투여됐으며, 램시마IV는 5mg/kg 용량으로 8주마다 투여됐다. 다만 램시마SC 120mg로 교체 투여받은 환자 중 초기에 반응을 보였지만 이후에 충분한 반응을 보이지 않은 환자는 SC 240mg으로 용량을 높여 투여받았다. 이후 치료 30주차가 되는 시점에 램시마IV를 계속 투여받던 환자군은 모두 램시마SC(120mg 또는 240mg)로 교체 투여받았다.

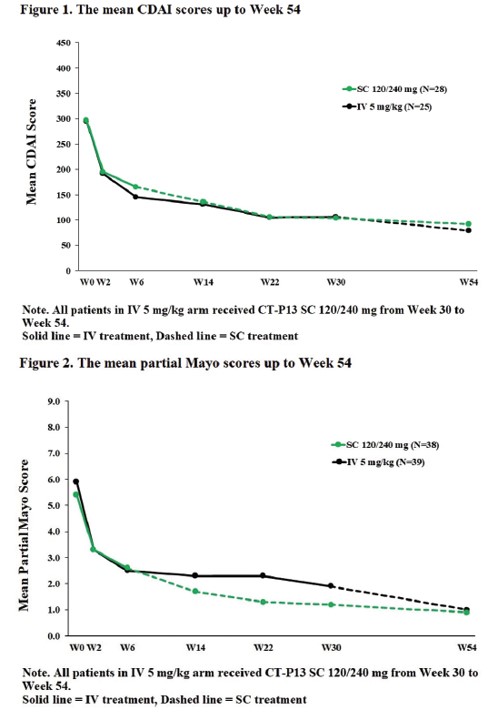
연구진은 치료 54주차에 두 환자군[램시마SC군(6~54주), 램시마IV(~30주)→SC군(30~54주)]의 ‘평균 크론병 활성도(mean Crohn's disease activity index, mean CDAI)’ 및 궤양성 대장염 환자의 증상을 나타내는 ‘부분 메이요 점수(partial Mayo score)’를 확인했다.
크론병 환자의 치료 반응률(clinical response)은 치료 전보다 CDAI 수치가 70점 이상 감소한 환자로 평가했으며, 치료 관해율(clinical remission)은 CDAI 수치가 150점 이하인 환자로 평가했다. 궤양성 대장염 환자의 치료 반응률은 치료 전보다 부분 메이요 점수가 2점 이상 감소한 환자, 치료 관해율은 부분 메이요 점수가 1점 이하인 환자로 평가했다.
그 결과, 초기(치료 0주, 2주)에 투여된 램시마IV는 두 환자군에서 임상적 활성을 높게 나타냈다. 램시마SC 투여 전인 치료 6주차에 두 환자군에서 크론병 환자의 치료반응률은 각각 75%(21/28명), 84%(21/25명)였으며, 궤양성 대장염 환자의 치료반응률은 각각 73.7%(28/38명), 77.5%(31/40명)였다. 두 환자군의 2가지 지표는 램시마IV에서 SC로 교체 투여받은 이후인 치료 30주차까지도 시간이 지남에 따라 수치가 감소하고, 개선된 치료반응률 및 관해율이 유지되는 결과를 보였다.
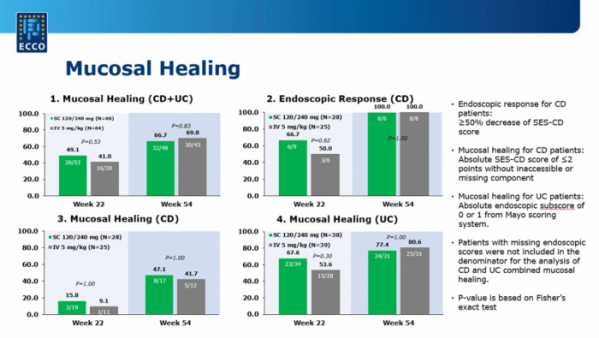
모든 환자군에서 내시경을 통해 관찰한 점막 치료 효과(mucosal healing)도 점차 향상된 결과를 보였다. 치료 22주차에 램시마SC군의 점막 치료 효과는 49.1%(26명/평가 가능한 53명), 램시마IV군에서는 41%(16명/39명)로 확인됐다. 치료 54주차에는 두 환자군에서 모두 점막 치료 효과가 향상돼 각각 66.7%(32/48명), 69.8%(30/43명)로 관찰됐다.
치료 54주차까지 램시마SC군과 램시마IV→SC군의 혈청 약물 농도는 유사하게 증가했다.
이상반응으로 두 환자군에서 국소적 주입부위반응이 관찰됐지만, 1~2등급의 경도 수준이었으며 대부분 치료 없이 회복됐다. 치료 6주~54주차까지 관찰된 치료 관련 심각한 이상반응은 램시마SC군에서 7.6%(5/66명), 램시마IV→SC군에서 9.2%(6/65명)였다.
연구진은 이번 연구 결과로 IBD 환자의 치료 옵션을 확장하기 위해 개발된 첫 피하주사 제형 '램시마SC'의 효능을 입증했다고 밝혔다. 특히 6주 후(신환), 30주 후(기존환자) 모두에서 교체처방이 가능하다는 점은 램시마SC의 확장성을 보여주는 것이다.
셀트리온은 이번 연구 결과에 대해 램시마IV로 효과를 극대화한 이후 병원 방문없이 환자 스스로 램시마SC를 투여해 약물 효과를 유지하게 하는 ‘듀얼 포뮬레이션(Dual Formulation)’ 전략을 뒷받침한 것이라고 설명했다.
셀트리온은 올해 중순까지 램시마SC의 IBD에 대한 적응증을 순차적으로 확보하고 레미케이드, 휴미라, 엔브렐 등이 주도하고 있는 약 50조원 규모의 글로벌 TNF-α(자가면역질환) 억제제 시장에서 새로운 시장을 창출한다는 계획이다.

![신라면·빼빼로·불닭까지...뉴욕은 지금 K푸드 앓이중[가보니(영상)]](https://img.etoday.co.kr/crop/140/88/2105685.jpg)


![송승헌ㆍ박지현, 밀실서 이뤄지는 파격 만남…영화 '히든페이스' [시네마천국]](https://img.etoday.co.kr/crop/140/88/2105818.jpg)
![강원도의 맛과 멋을 모두 느낄 수 있는 '단단단 페스티벌' 外[주말N축제]](https://img.etoday.co.kr/crop/140/88/2105750.jpg)


![“한국서 느끼는 유럽 정취” 롯데 초대형 크리스마스마켓 [가보니]](https://img.etoday.co.kr/crop/140/88/2105976.jpg)



![[ENG/SUB]지드래곤(G-DRAGON)의 음악, 다른 아이돌과 뭐가 다른데? [컬처콕 플러스]](https://i.ytimg.com/vi/9hsaYzMk9gc/mqdefault.jpg)






![신라면·빼빼로·불닭까지...뉴욕은 지금 K푸드 앓이중[가보니(영상)]](https://img.etoday.co.kr/crop/85/60/2105685.jpg)
![증상도 없이 ‘말기’…간암 어떻게 극복할까[e건강~쏙]](https://img.etoday.co.kr/crop/85/60/2105800.jpg)
![“한국서 느끼는 유럽 정취” 롯데 초대형 크리스마스마켓 [가보니]](https://img.etoday.co.kr/crop/85/60/2105976.jpg)
![[BioS]동아제약, 국가품질혁신경진대회 "대통령상 수상"](https://img.etoday.co.kr/crop/85/60/2105265.jpg)
!["여기도 품절이라고요?"…Z세대 '뷰티 방앗간' 된 다이소, 다음 대란템은? [솔드아웃]](https://img.etoday.co.kr/crop/300/170/2105870.jpg)
![절기상 소설, 눈 대신 낙엽 [포토]](https://img.etoday.co.kr/crop/300/190/2105757.jpg)