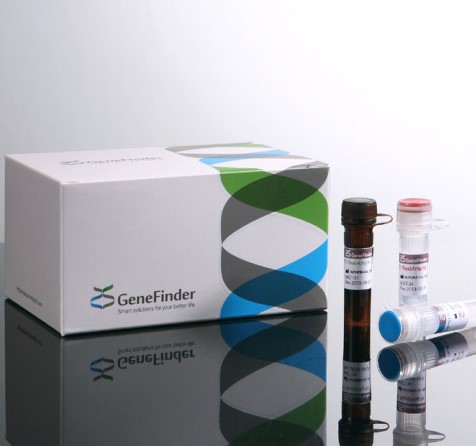
19일 이의섭 오상헬스케어 상무는 본지와 전화통화를 통해 국내 최초로 자사의 코로나19 진단키트(GeneFinder COVID-19 Plus RealAMPKit) 긴급승인 소감을 이같이 밝혔다.
EUA의 첫 스타트를 끊은 오상헬스케어는 각종 성인병 및 바이러스 질병진단 의료기기 전문업체로, 3월 6일 EUA승인을 신청한지 두 달도 안돼 국내 기업 중 가장 빠르게 미국 시장에 진입하게 됐다. 앞서 진행된 미국 연방재난관리청(FEMA)과의 계약에 이어 이번 EUA 승인까지 더해지며 미국 전역에 코로나19 진단키트 수출이 가능해진 오상헬스케어의 홈페이지는 현재 접속량 초과로 마비 상태다.
미국 진출을 위해선 FDA의 긴급사용승인을 받거나 주 정부 관리하에 있는 진단검사회사의 검증을 거쳐야 진출할 수 있는데, 국내 기업 중 FDA EUA를 통한 미국 진출은 오상헬스케어가 최초다.
이번 EUA의 빠른 승인에 대해 회사는 그간 해외 인증 및 수출에 대한 다수의 경험과 미국 전담팀의 대응전략이 주효했다고 자체 평가하고 있다. 이 상무는 “FDA의 요청에 일사분란하게 움직일 수 있었던 데는 자사의 진단 제품에 대한 FDA 정식 승인 절차 경험 및 유럽 등 다수 국가의 해외수출 경험치가 쌓여 즉각 대응이 가능했던 덕분”이라며 “그 결과 단기간만에 국내 기업 중 가장 빠른 결과를 얻게 된 것”이라고 설명했다.
그러면서 이 상무는 이번 EUA승인을 통해 FDA의 까다로운 장벽을 다시한번 느꼈다고 전했다. 그는 “FDA는 제품의 성능, 관리 등 기술적 요건에 대한 검증을 위해 세분화된 자료 요청이 굉장히 많았다”며 “오직 기술적인 내용만 까다롭게 요구해와 자료 제출을 위해 사내 각 분야 직원들이 총동원될 수 밖에 없었다”고 강조했다.
오상헬스케어는 다음 주부터 새로운 계획들이 진행될 것임을 예고했다. 그는 “현재 다 밝힐 수는 없지만 이미 EUA신청과 동시에 미국 내 수출에 대한 다양한 전략이 마련돼 있다"며 "다음주부터 실행에 들어갈 수 있을 것”이라고 밝혔다.
한편 미국 시장에 선보이게 되는 오상자이엘의 코로나19 진단키트는 실시간 유전자증폭검사(RT-PCR) 방식으로 코로나바이러스의 목표유전자 3종(E Gene, RdRp Gene, N Gene)을 정성 검출할 수 있으며 1개 튜브(Tube)로 동기 검사가 가능해 대용량 검사에 사용자 편의성과 효율성을 높인 제품이다. 현재 세계 70여개국으로부터 쇄도하는 수출 문의에 대응하고 있으며 물량대응을 위해 생산능력을 확충한 상태다.



![김상겸 깜짝 은메달…반전의 역대 메달리스트는? [2026 동계올림픽]](https://img.etoday.co.kr/crop/140/88/2293020.jpg)
!["인스타그램 정지됐어요"⋯'청소년 SNS 금지', 설마 한국도? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2293582.jpg)


![진짜인 줄 알았는데 AI로 만든 거라고?…"재밌지만 불편해" [데이터클립]](https://img.etoday.co.kr/crop/140/88/2293549.jpg)




!["엔비디아가 골목길 입구까지 쫓아왔다?" 자율주행 사이다 팩트 체크 [찐코노미] #테슬라](https://i.ytimg.com/vi/tIWc3d9GgOE/mqdefault.jpg)










!["인스타그램 정지됐어요"⋯'청소년 SNS 금지', 설마 한국도? [이슈크래커]](https://img.etoday.co.kr/crop/300/170/2293582.jpg)
![정치·외교·통일·안보 대정부질문, 답변하는 김민석 총리 [포토]](https://img.etoday.co.kr/crop/300/190/2293534.jpg)