국산 신종 코로나바이러스 감염증(코로나19) 진단키트가 전 세계 110여 개국에 5600만여 명을 검사할 수 있는 분량이 수출된 것으로 나타났다.
식품의약품안전처는 73개 코로나19 진단키트 제품이 수출용으로 허가받아 미국과 이탈리아, 브라질, 사우디아라비아, 이집트, 인도네시아 등 110여 개국에 약 5646만 명 분량 수출됐다고 22일 밝혔다. 이 가운데 7개 제품은 미국 식품의약국(FDA) 긴급사용승인을 획득했다.
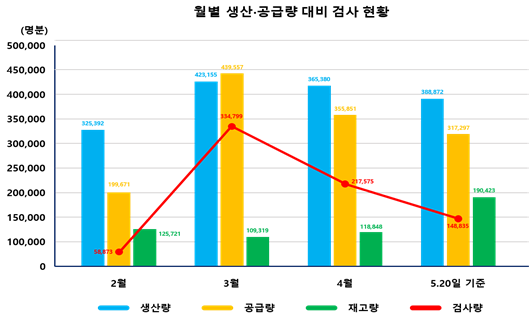
식약처는 코로나19 발생 후 코젠바이오텍, 씨젠, 솔젠트, 에스디바이오센서, 바이오세움, 바이오코아의 총 6개 제품을 긴급사용 승인했다. 이들 6개 제품의 1일 최대 생산량은 약 15만 명분으로 20일 기준 누적 총생산량은 150만 명분이다.
국내에는 이 가운데 131만 명분이 공급돼 지금까지 총 76만 건의 검사를 진행했다. 19만 명분은 재고로 확보해 안정적인 수급을 이어가고 있다.
식약처는 진단까지 6시간 걸리는 기존 긴급사용승인 제품과는 별개로 1시간 이내에 결과가 나오는 '응급용' 코로나19 진단키트를 승인하기 위한 절차를 마련해 응급수술 등 시급한 환자에 사용할 예정이다.
앞으로 식약처는 긴급사용 승인 제품과 수출용 허가 제품의 정식허가 전환을 통해 K-진단키트의 품질에 대한 글로벌 신뢰도를 높여 나갈 예정이다. 단계별 밀착 지원을 통해 현재 서류 준비부터 허가까지 200일가량 걸리는 시간도 59일로 대폭 단축할 계획이다.
이와 함께 식약처는 관련 부처 및 민간전문가와 협력해 '감염병 진단기법' 관련 표준 2종 및 '진단키트 긴급사용승인 절차' 관련 표준 1종 등 K-방역 모델의 국제표준 제정 작업을 추진한다. 이미 '유전자 증폭기반 진단기법' 국제표준은 지난 2월 국제표준화기구 의료기기 기술위원회(ISO/TC 212)에서 국제표준안(DIS)으로 승인돼 각 회원국의 최종 승인절차를 거쳐 연내 국제 표준 제정이 완료될 전망이다.
또한, 지난 1일부터 '체외진단의료기기법'이 시행됨에 따라 체외진단기기 특성에 맞춘 전주기 안전관리체계를 도입, 맞춤형 안전관리체계를 구축하고 전문성을 강화한다.
식약처는 포스트 코로나 시대를 대비해 국내 진단시약의 품질향상과 임상평가 전문성을 높이고 유전자증폭장치, 핵산추출시약 등 주요 체외진단 제품의 국산화를 지원한다.
양진영 식약처 차장은 "앞으로도 진단키트의 생산과 수급상황을 꼼꼼히 모니터링하고, 국내의 안정적 수급을 유지하면서 해외 수출지원에 힘쓰겠다"면서 "긴급사용승인 등 신속한 대응으로 K-진단키트의 글로벌 위상이 높아진 만큼, 포스트 코로나 시대에도 K-방역의 명성을 확고히 하겠다"고 말했다.


![물가 불안 주범 '불공정·독과점' 정조준...공정위 이례적 전면에 [물가 안정, 독과점 정조준]](https://img.etoday.co.kr/crop/140/88/2258651.jpg)
![또 소환된 2018 평창올림픽 선수촌 식당 [2026 동계올림픽]](https://img.etoday.co.kr/crop/140/88/2294877.jpg)
!['당'에 빠진 韓…당 과다 섭취 10세 미만이 최다 [데이터클립]](https://img.etoday.co.kr/crop/140/88/2294883.jpg)







!["엔비디아가 골목길 입구까지 쫓아왔다?" 자율주행 사이다 팩트 체크 [찐코노미] #테슬라](https://i.ytimg.com/vi/tIWc3d9GgOE/mqdefault.jpg)


![롯데물산, 새해맞이 ‘2026 롯데 루미나리에 Wish Shines On’ 개최 [포토]](https://img.etoday.co.kr/crop/85/60/2295007.jpg)







!['당'에 빠진 韓…당 과다 섭취 10세 미만이 최다 [데이터클립]](https://img.etoday.co.kr/crop/300/170/2294883.jpg)
![국회 본회의, 교육·사회·문화 분야 대정부질문 [포토]](https://img.etoday.co.kr/crop/300/190/2294931.jpg)