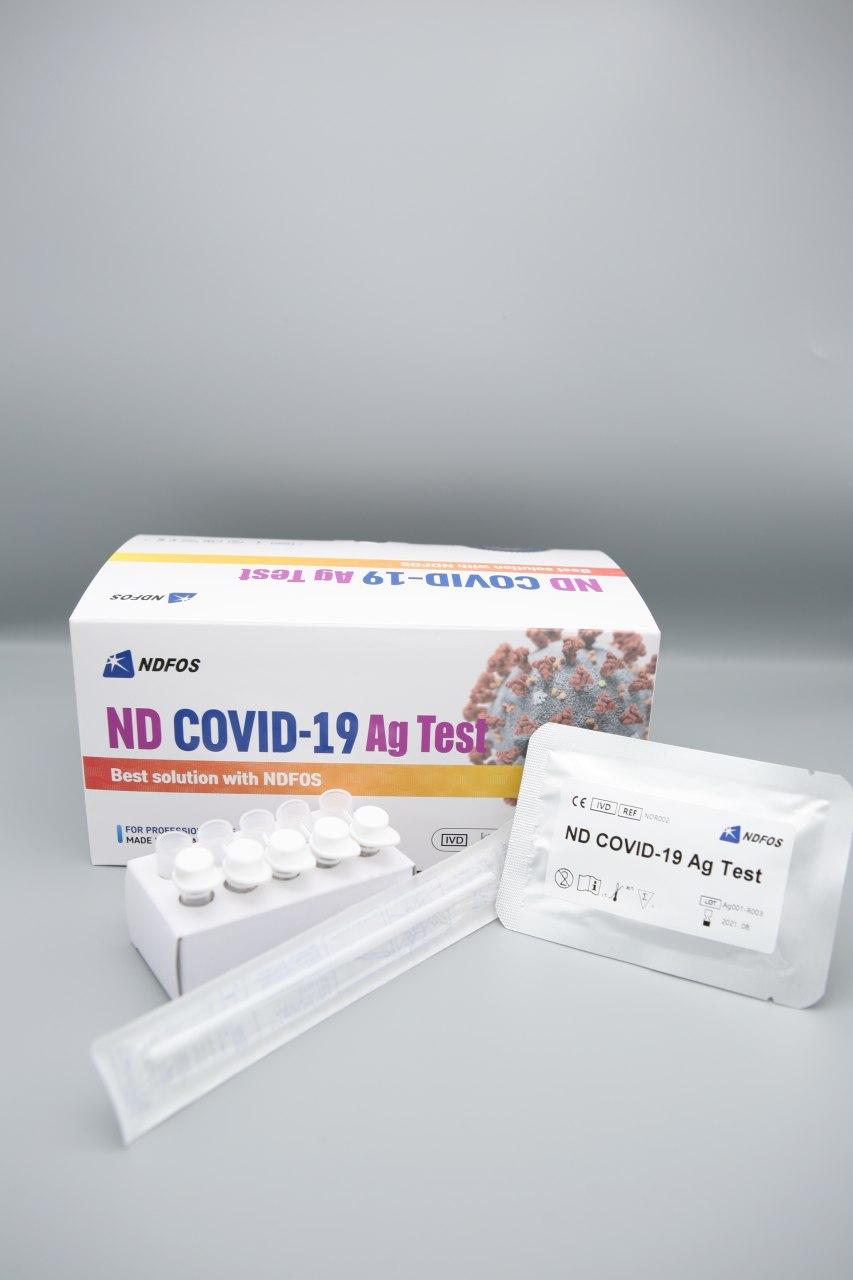
앤디포스가 코로나19 항원신속진단키트 ND COVID-19 Ag Test의 식품의약품안전처(식약처) 수출허가를 획득했다고 16일 밝혔다.
앤디포스는 지난 9월 항원신속진단키트의 유럽인증 (CE)을 받은 데 이어 향후 미국 식품의약국(FDA) 승인도 추진할 예정이다.
이번에 수출허가를 받은 항원신속진단키트는 코로나19 초기 감염환자의 ‘비인두 도말’ 검체를 이용해 10분 이내에 감염 여부를 판별할 수 있어 조기 방역이 가능하다. 특히 고가의 검사장비와 전문인력이 필요 없다. 코로나19 확진자가 급증하는 국가나 지역에서 1차 선별 진단용으로 선호하고 있다.
선진국에 비해 상대적으로 방역 인프라가 미흡한 인도, 동남아시아, 남미 지역과 같이 최근 급속하게 코로나19가 확산되는 지역에서 항원신속진단키트에 관한 수요가 급증하고 있다.
앤디포스 관계자는 “최근 여러 국가에서 1차 선별검사용으로 항원 신속진단키트를 도입하고 있어, 이번 수출허가 이전부터 해외 바이어들의 주문요청이 쇄도하고 있던 상황”이라며 “이번 식약처 수출허가에 대비해 각국 정부에 판매허가 신청을 진행해와 수출이 확대될 것”이라고 말했다.
이어 “당사는 중화항체 진단키트, 코로나〮인플루엔자 항원 동시진단키트 등 신규 제품들에 관한 수출허가와 해외 인증도 조속히 진행할 것”이라며 “급변하는 진단시장 수요에 효과적인 대응을 해 나갈 계획”이라고 강조했다.
앤디포스는 △분자진단(PCR) 키트 △항체 및 항원 신속 진단키트 △코로나·인플루엔자 동시 분자진단키트에 관한 수출허가와 유럽인증을 모두 획득해 다양한 국가별 방역정책에 맞는 제품 포트 폴리오를 갖추고 있다.



!["다같이 단종 안아"⋯'왕사남', 과몰입 비결 탈탈 털어보니 [엔터로그]](https://img.etoday.co.kr/crop/140/88/2299262.jpg)
![배당금 받으려면 언제까지 사야 할까?…2월 국내 배당주 정리 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2299248.jpg)







![현대차 주가, 이제 '숫자'로 보지 마세요. 삼성전자보다 무서운 진짜 이유 [찐코노미]](https://i.ytimg.com/vi/TfLr6_Ne1wA/mqdefault.jpg)
!["어디까지 갈까"…삼전 27만원·SK하이닉스 160만원 목표가 등장[20만전자·100만닉스 시대]](https://img.etoday.co.kr/crop/85/60/2299222.jpg)

![[장외시황] 현대오일뱅크, 4.55% 상승](https://img.etoday.co.kr/crop/85/60/2299329.jpg)

![[급등락주 짚어보기] AI 보안과 전력 반도체의 '기술 승리'…한화비전·한국전자홀딩스 등 '上'](https://img.etoday.co.kr/crop/85/60/2299295.jpg)




!["다같이 단종 안아"⋯'왕사남', 과몰입 비결 탈탈 털어보니 [엔터로그]](https://img.etoday.co.kr/crop/300/170/2299262.jpg)
![국민의힘, 상법 개정안 필리버스터 '돌입' [포토]](https://img.etoday.co.kr/crop/300/190/2299313.jpg)