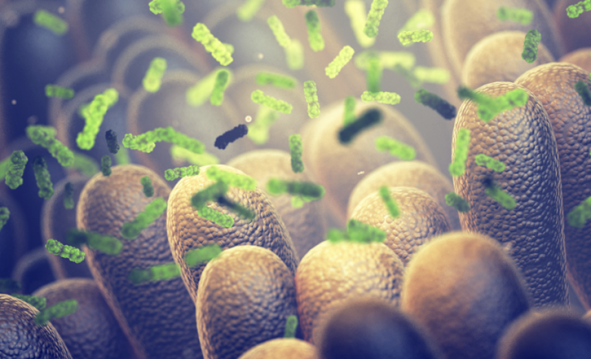
마이크로바이옴 신약개발 바이오텍 고바이오랩(KoBioLabs)이 미국 식품의약국(FDA)으로부터 면역질환파이프라인 ‘KBL697’의 임상2a상 승인을 받았다고 5일 밝혔다.
KBL697(프로젝트명: KBLP-007)은 주요 난치성 면역질환으로 알려져 있는 궤양성 대장염(ulcerative colitis, UC)를 타깃한다. 고바이오랩은 임상1상에서 KBL697의 안전성과 내약성을 확인한 바 있다.
이번 임상2a상은 경도(mild) 내지 중등도(moderate) 궤양성 대장염 환자에게 항생제를 전투여(pre-treatment)한 후 KBL697를 8주간 투약해 유효성, 안정성 등 치료 효능을 확인하도록 디자인했다.
고바이오랩 관계자는 “해당 임상은 호주에서 진행할 예정으로 호주 연방의료제품청(TGA)에 보고 후 호주내 8개 기관에서 궤양성 대장염 환자를 대상으로 실시할 계획”이라며 “연내 투약 개시를 목표로 하고 있다”고 밝혔다.
한편 KBL697은 BaxBank에서 동일 종(species)내에서 항염증 IL-10 유도능력이 가장 뛰어난 생균을 발굴한 것이다. 염증성 장질환(IBD) 모델에서 TNF-α 약제와 유사한 효능을 확인한 바 있다.

![금상추에 배추·무까지…식품업계, 널뛰는 가격에 불확실성 고조 [식탁 지배하는 이상기후]](https://img.etoday.co.kr/crop/140/88/2104899.jpg)
![[단독]한달 된 '실손24' 60만 명 가입…앱 청구 고작 0.3% 불과](https://img.etoday.co.kr/crop/140/88/2106205.jpg)









![[ENG/SUB]지드래곤(G-DRAGON)의 음악, 다른 아이돌과 뭐가 다른데? #홈스위트홈 #homesweethome [컬처콕 플러스]](https://i.ytimg.com/vi/9hsaYzMk9gc/mqdefault.jpg)


![[인터뷰]“하루·델리오 파산 선고…‘출금중단’ 피해 회복 첫 단추 의미 커”](https://img.etoday.co.kr/crop/85/60/2105939.jpg)
![[식물 방통위] 소송비용만 4억…'정쟁 지옥'에 빠진 방통위](https://img.etoday.co.kr/crop/85/60/2106213.jpg)
![[식물 방통위] 정쟁 속 수년째 멈춤…여야 합의제 부처의 한계](https://img.etoday.co.kr/crop/85/60/2106212.jpg)
![해외선 스마트팜 지원·법 속속…이상기후 극복법은? [식탁 지배하는 이상기후]](https://img.etoday.co.kr/crop/85/60/2105913.jpg)
![강성지 웰트 대표 “해외서 배워 국내 DTx 산업발전에 기여할 것” [메디컬 줌인]](https://img.etoday.co.kr/crop/85/60/2105900.jpg)
![금상추에 배추·무까지…식품업계, 널뛰는 가격에 불확실성 고조 [식탁 지배하는 이상기후]](https://img.etoday.co.kr/crop/85/60/2104899.jpg)
![이상기후 대안은 스마트팜…이마트 협업 농장서 찾은 해법 [가보니] [식탁 지배하는 이상기후]](https://img.etoday.co.kr/crop/85/60/2104872.jpg)

!["여기도 품절이라고요?"…Z세대 '뷰티 방앗간' 된 다이소, 다음 대란템은? [솔드아웃]](https://img.etoday.co.kr/crop/300/170/2105870.jpg)
![휘발유-경유, 6주 연속 동반 '상승' [포토]](https://img.etoday.co.kr/crop/300/190/2106198.jpg)