바이오니아는 자회사 써나젠테라퓨틱스가 23일 RNAi 후보물질 ‘SAMiRNA-AREG’이 비임상 독성시험에서 최고 농도 투여시에도 돌연변이·염색체이상 등을 유발하지 않는 것으로 나타났다고 밝혔다.
써나젠의 SAMiRNA-AREG는 폐·신장 섬유증 등을 대상으로 임상 1상 신청을 준비 중이다.
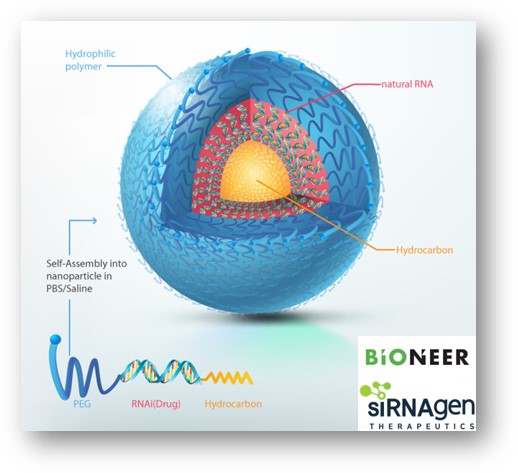
SAMiRNA-AREG는 EGFR의 리간드이자 섬유화의 핵심인자로서 신장섬유화증의 발생 기전에 중요한 역할을 하는 AREG(amphiregulin)를 타깃한다. SAMiRNA-AREG은 바이오니아가 자체 보유한 RNAi 신약 플랫폼 기술인 SAMiRNA 기술을 적용했다. SAMiRNA 기술은 염기서열 20개 안팎의 siRNA 양끝에 각각 친수성·소수성 물질을 결합한 나노입자형 siRNA 신약 플랫폼이다.
바이오니아는 이번 유전독성 및 일반독성 연구에서 SAMiRNA-AREG의 안전성을 확인했다. 먼저 바이오니아는 차이니즈 햄스터(Chinese Hamster)의 폐 세포에 ㎖당 125㎍, 250㎍, 500㎍의 SAMiRNA-AREG을 처리한 결과 모든 농도에서 염색체 이상이 나타나지 않을 결과를 확인했다. 쥐 장티푸스균(Salmonella Typhimurium)과 트립토판 필요 대장균(tryptophan-requiring Escherichia coli)의 5개 균주를 대상으로 한 실험에서도 모든 농도의 SAMiRNA-AREG 투여군에서 돌연변이체 수가 유의미하게 증가하지 않았다(doi:10.1080/01480545.2021.1908003).
또 바이오니아는 생후 7주 된 암컷·수컷 마우스 모델에 체중 1㎏당 75㎎, 150㎎, 300㎎의 SAMiRNA-AREG을 투여했다. 그 결과 모든 SAMiRNA-AREG 투여군의 골수세포에서 염색체이상에 대한 마커인 소핵다염성 적혈구 발생과 세포 독성 마커로 사용되는 총 적혈구 수 대비 미성숙 적혈구의 비율이 증가하지 않았다.
마우스 모델을 이용한 4주 반복투여 일반독성시험 결과도 긍정적이었다(doi:10.1177/10915818211031241). 이 실험은 4주간 SAMiRNA-AREG을 주 1회, 총 5회 정맥투여해 발생하는 독성학적 변화와 이후 2주동안의 회복여부를 확인한다. 그 결과 4주간 투여 후 독성학적 변화는 정상 범위 안에 있었으며, 체중 1㎏당 100㎎, 200㎎, 300㎎의 SAMiRNA-AREG 투여군 모두 생존률, 의학적 특이 소견, 체중, 사료 섭취량, 눈·혈액·임상화학·소변검사 등에서 부작용이 관찰되지 않았다. SAMiRNA-AREG 300㎎ 투여군에서 비장 무게가 일시적으로 약 1.6배 증가했지만 투여 종료 2주 뒤 정상화됐다.
바이오니아는 SAMiRNA-AREG의 섬유증 모델 동물과 세포실험에서 신장섬유증 진행을 효과적으로 억제한 결과를 보고한 바 있다(doi.org/10.1038/s41598-021-81726-2). SAMiRNA-AREG는 마우스 모델의 신장에 전달돼 파이브로넥틴, α-SMA, 콜라겐 등 섬유화 마커, 염증 마커과 EGFR의 인산화(phosphorylation)를 감소시킨 결과를 확인했다.
폐·신장 섬유증은 만성 염증반응 과정에서 조직·장기에 콜라겐 등 섬유성 결합조직이 과도하게 형성돼 점차 딱딱하게 굳어지면서 제 기능을 못해 호흡곤란, 신장 기능저하·장애 등을 유발한다. 심한 경우 장기이식을 받지 않으면 사망할 수 있다.
써나젠 관계자는 “SAMiRNA-AREG은 앞서 섬유증 모델 동물실험과 세포실험에서 섬유증 진행을 효과적으로 억제했고, 생명에 직접적 영향을 미치는 심혈관계·호흡기계·중추신경계 기능에 악영향을 미치지 않는 등 약리학적으로 안전한 결과를 보였다”며 “이번 비임상 독성시험을 통해 섬유증 치료제 개발에 유리한 안전성 프로파일도 확보했다”고 말했다.
한편 바이오니아는 자회사인 써나젠을 통해 코로나19로 인한 폐섬유증 치료제 후보물질 SAMiRNA-AREG의 임상 1상을 연내 신청할 계획이다.



















![밥상의 온기와 인간 중심 서사로 관객 사로잡은 ‘왕과 사는 남자’[리뷰]](https://img.etoday.co.kr/crop/85/60/2295902.jpg)



![2월 둘째 주 유튜브 영상 순위 [이투PICK 순삭랭킹]](https://img.etoday.co.kr/crop/300/170/2278370.jpg)
![설날, 분주한 김포공항 '북적' [포토]](https://img.etoday.co.kr/crop/300/190/2296440.jpg)