한미약품(Hanmi Pharmaceutical)의 첫 이중항체 프로그램이 임상개발 단계로 진입한다. 한미약품은 최근 식품의약품안전처로부터 PD-L1x4-1BB 이중항체(BsAb) 후보물질 ‘BH3120’의 국내 임상1상 임상시험계획서(IND)를 승인받았다고 22일 밝혔다.
앞서 한미약품은 지난 5월 미국 식품의약국(FDA)로부터 해당 후보물질에 대한 IND 승인을 받은 바 있다. 이에 따라 한미약품은 연내 국내와 미국에서 임상1상을 시작할 계획이다.
BH3120은 한미약품과 북경한미약품(Beijing Hanmi Pharm)과 개발한 서로 다른 표적에 결합하는 ‘1+1’ 구조의 펜탐바디(Pentambody) 기술을 적용한 이중항체이다. 면역글로불린G(IgG)과 유사한 구조를 가진다. BH3120은 PD-L1과 4-1BB 각각에 대한 결합 특성을 다르게 디자인해, 차별화된 효능과 안전성 프로파일을 가진다고 회사측은 설명했다.
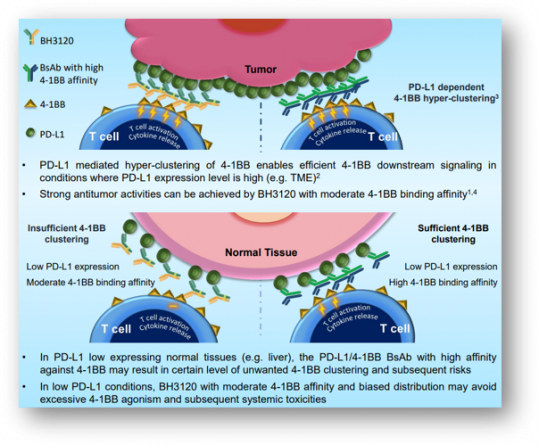
기존에 개발됐던 4-1BB 단일클론 항체는 타깃하는 에피토프(epitope) 특성에 따라 전신투여시 항암활성을 보이면서 간 독성(hepatotoxicity)을 나타내거나, 효능이 미미한 한계점이 있었다. BH3120은 이중항체 구조를 통해 PD-L1을 과발현하는 종양미세환경(TME) 내에서 4-1BB를 매개로 T세포를 활성화시켜, 더 높은 효능을 한미는 기대하고 있다.
한미약품은 BH3120 단독투여에 따른 효능 외에도 PD-1 면역관문억제제와 병용투여할 시 높은 항암 효능을 나타내는 것을 확인했다. BH3120은 영장류 안전성 연구에서 독성 및 면역관련 부작용이 관찰되지 않았으며, 현재 개발중인 경쟁품목 대비 우수한 수준의 안전성 프로파일이 확인됐다.
한미약품은 올해 4월 열린 미국암연구학회(AACR 2023)에서 BH3120이 PD-L1 발현 종양미세한경에서 4-1BB 클러스터링(hyper-clustering)을 통해 면역세포를 활성화시키는 반면, 정상조직에서는 활성화를 일으키지 않아 종양조직과 정상조직 사이 뚜렷한 디커플링(decoupling; 구분) 현상을 관찰했다고 발표했다.
또한 면역항암제에 잘 반응하지 않는 종양쥐모델(B16/F10-hPD-L1)에서 BH3120과 PD-1 면역관문억제제 ‘키트루다’를 병용투여했을 때, 경쟁약물인 젠맙(Genmab)-바이오엔텍(BioNTech)의 PD-L1x4-1BB 이중항체 ‘GEN1046’의 병용투여 대비 동등 이상의 종양성장억제 효능을 확인했다.
한미약품 관계자는 “BH3120은 차세대 이중항체 플랫폼 기술 ‘펜탐바디’를 활용해 글로벌 임상개발을 진행하는 첫 번째 프로젝트”라며 “한미의 독자 플랫폼 기술 ‘랩스커버리’ 뒤를 잇는 ‘펜탐바디’가 한미의 탄탄한 미래 가치를 지속적으로 창출해 낼 것으로 기대한다”고 말했다.









![명절에 선물 받은 건강기능식품, 약과 함께 먹어도 될까? [e건강~쏙]](https://img.etoday.co.kr/crop/140/88/2297575.jpg)














![전두환과 평행이론...윤석열 '내란죄 무기징역' 의미는? [인포그래픽]](https://img.etoday.co.kr/crop/300/170/2297723.jpg)
![햄버거도 부담…맥도날드 오늘부터 가격 '인상' [포토로그]](https://img.etoday.co.kr/crop/300/190/2297764.jpg)