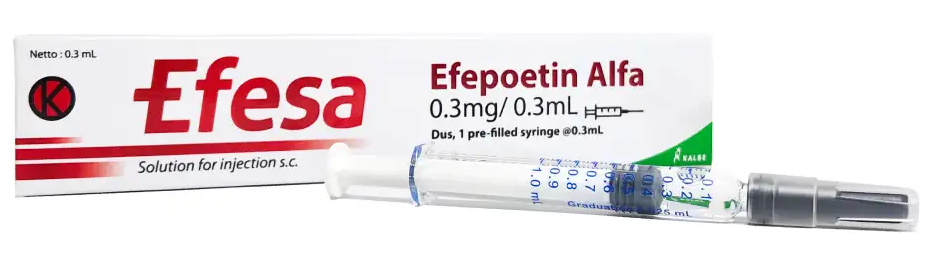
제넥신은 식품의약품안전처에 지속형 빈혈치료제 에페사®(GX-E4)에 대한 바이오의약품 품목허가신청(BLA)을 완료했다고 26일 공시했다.
제넥신과 칼베(Kalbe)가 합작 설립한 KG바이오(KGBio)는 지난해 신성빈혈 치료제 에페사)의 비투석 만성신장질환 환자 대상 임상 3상을 성공적으로 마무리하고 지난해 10월 인도네시아 식약처(BPOM)의 품목허가를 받았다.
에페사는 제넥신의 지속형 플랫폼 기술 hyFc®(하이-에프씨)를 적용해 적혈구 생성을 촉진하는 호르몬인 EPO(에리스로포이에틴)의 체내 반감기를 획기적으로 늘렸다. 기존 1세대 빈혈치료제가 2~3일마다 1회 주기로 투여해야 했다면, 에페사는 2주 혹은 최장 4주에 한 번만 주사하면 되는 3세대 치료제다.
한국을 포함한 7개국에서 투석치료를 받지 않는 신성빈혈 환자 391명을 대상으로 진행한 에페사 비투석환자 임상 3상 결과, 평가 종료 시점의 헤모글로빈(Hb) 반응률은 GX-E4군이 75.6%, 미쎄라®군이 69.3%로 1차 평가지표를 만족했다. 안전성과 내약성 평가에서도 동등한 결과를 보여 글로벌 블록버스터 치료제 미쎄라 대비 비열등성을 입증했다.
제넥신 관계자는 “국내 바이오 기업 최초로 후보물질 발굴부터 상업화까지 도전하게 되는 사례가 될 것”이라며 “투석치료를 받는 만성신장질환 환자를 대상으로 한 임상 3상의 첫 환자 투여가 25일 계획대로 진행돼 이달 KG바이오로부터 선급금을 받을 예정”이라고 말했다.
의약품 유통 실적 자료에 따르면 지난해 국내 신성 빈혈치료제 시장은 약 1000억 원 규모로 알려져 있다.







![포켓몬, 아직도 '피카츄'만 아세요? [솔드아웃]](https://img.etoday.co.kr/crop/140/88/2296074.jpg)









![“명절 장바구니 비상”… 사과·계란·쌀값 인상에 정부 40% 할인 지원[물가 돋보기]](https://img.etoday.co.kr/crop/85/60/2293150.jpg)





![삼성전자 지금 사도 될까…"설 이후 한 번 더 상승 여력" [찐코노미]](https://img.etoday.co.kr/crop/300/170/2296128.jpg)
![중국 춘절 연휴 시작, 북적이는 명동거리 [포토]](https://img.etoday.co.kr/crop/300/190/2296286.jpg)