필룩스는 미국 자회사인 ViralGene에서 연구 중인 면역항암제 ‘AD5-GUCY2C-PRADE’와 관련해 미국 식품의약국(FDA)에 임상 2상을 신청했다고 14일 밝혔다.
회사에 따르면 임상 1상을 통해 안정성과 효력을 인정받은 ViralGene의 면역항암제는 미국에서 임상 2상을 위한 모든 준비를 마쳤다. 필룩스의 면역항암제는 미국 FDA로부터 희귀질환치료제(ODD)로 지정받게 되면 임상 2상 후 판매 허가가 가능하다. 이에 막대한 자본과 시간이 투여되는 임상 3상을 진행하지 않고 바로 판매할 수 있어 바이오 시장에서 주목받고 있다.
회사 관계자는 “ViralGene의 면역항암제는 FDA 담당자와의 사전 회의를 통해 전임상ㆍ임상 1상 시험결과와 임상 설계에 대한 전반적인 내용을 검토한 결과 임상 2상 시험 신청 진행에 문제가 없음을 확인받았다”고 전했다.
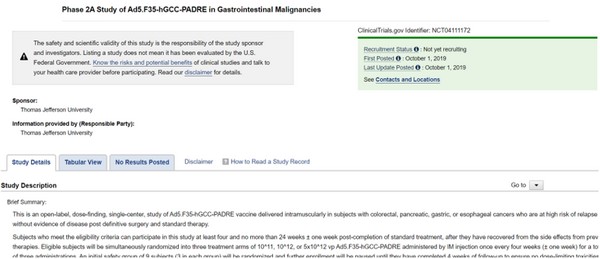
필룩스는 최근 임상 2상 신청서류를 FDA에 제출했으며, ViralGene의 신약은 FDA로부터 신약 코드를 부여받아 미국국립의학도서관에 등록된 상태이다. 미국국립의학도서관 웹사이트에서 NCT 번호(NCT04111172)로 검색해 진행 상황을 확인할 수 있다.
이번 임상 2상은 미국 필라델피아 토머스제퍼슨 대학교(Thomas Jefferson University)의 시드니 키멜 암연구소(Sidney Kimmel Cancer Center)에서 위암, 췌장암, 식도암, 대장암 환자를 대상으로 2년 내외로 진행될 계획이다.
필룩스의 미국 신약 수석연구원이자 토머스제퍼슨 대학교 암센터 교수인 아담 스누크 박사는 “인간의 팔에 백신을 주입하면 면역세포가 온몸으로 퍼져 폐와 간 등의 다른 곳에서 암세포를 찾아낼 수 있다”며 “2단계 연구는 특정 암세포를 표적으로 삼고 파괴하는 데 중점을 두고 진행될 예정”이라고 말했다.
필룩스 한우근 대표이사는 “ViralGene의 면역항암제 임상 2상이 성공적으로 완료되면 전 계 암 치료 패러다임에 커다란 변화를 일으킬 것이며 이른 시일 내에 미국과 세계시장에 신약을 판매할 수 있을 것으로 기대하고 있다”고 전하며, 성공적인 임상 2상 진행에 대한 자신감을 표현했다.

![한미일 정상 "北, 러 파병 강력 규탄" 공동성명…'3국 협력사무국' 출범 [종합]](https://img.etoday.co.kr/crop/140/88/2102991.jpg)
!['바람의나라 클래식', 원작 재현만으로 장기 흥행 가능할까 [딥인더게임]](https://img.etoday.co.kr/crop/140/88/2102375.jpg)

![하루 시작부터 끝까지…변우석과 함께 보내는 하루! [솔드아웃]](https://img.etoday.co.kr/crop/140/88/2102822.jpg)
![달콤한 밤 크림에 촉촉함까지…화제의 ‘밤 티라미수’ [맛보니]](https://img.etoday.co.kr/crop/140/88/2102787.jpg)
!['먹을 복' 넘치는 따뜻한 가을, '순창 떡볶이 페스타' 外[주말N축제]](https://img.etoday.co.kr/crop/140/88/2102791.jpg)
![[해보니] 화려한 액션ㆍ생생한 그래픽…펄어비스 ‘붉은사막’ 인기 활활](https://img.etoday.co.kr/crop/140/88/2102858.jpg)




![[ENG/SUB]'뉴 클래식' 내세운 베몬(BABYMONSTER), YG 선배 걸그룹들과 무엇이 달랐나?#drip #clikclak [컬처콕 플러스]](https://i.ytimg.com/vi/bq-OCu_Uy8E/mqdefault.jpg)
![[투자전략] 미국 주식 대박 나자 너도나도 ‘양도세 폭탄’…절세 꿀팁은](https://img.etoday.co.kr/crop/85/60/2103011.jpg)

![[베스트&워스트] 지엔씨에너지, 사상 최대 분기 실적에 49%↑](https://img.etoday.co.kr/crop/85/60/2102975.jpg)
![[베스트&워스트] TYM, 방한한 우크라 국회의원단과 회동…재건 기대감↑](https://img.etoday.co.kr/crop/85/60/2102972.jpg)
![[주간증시전망] 코스피 2400·코스닥 700·삼성전자 깨진 주…다음 주 2350 하단](https://img.etoday.co.kr/crop/85/60/2102872.jpg)


![[오늘의 주요공시] 휴니드·문배철강·NI스틸 등](https://img.etoday.co.kr/crop/85/60/2102401.jpg)

![[장외시황] 에스엠랩, -15.79% 하락](https://img.etoday.co.kr/crop/85/60/2102843.jpg)
!['바람의나라 클래식', 원작 재현만으로 장기 흥행 가능할까 [딥인더게임]](https://img.etoday.co.kr/crop/300/170/2102375.jpg)
![내년부터 배달앱 중개 수수료 2.0~7.8%로 '차등화' [포토]](https://img.etoday.co.kr/crop/300/190/2102947.jpg)