식품의약품안전처는 인보사의 주성분 가운데 세포 1개 성분이 허가 당시와 다른 점이 확인돼 이 같은 내용을 코오롱생명과학에 요청했다고 31일 밝혔다.
코오롱생명과학은 자발적으로 이날 해당 제품의 유통·판매를 중지했다.
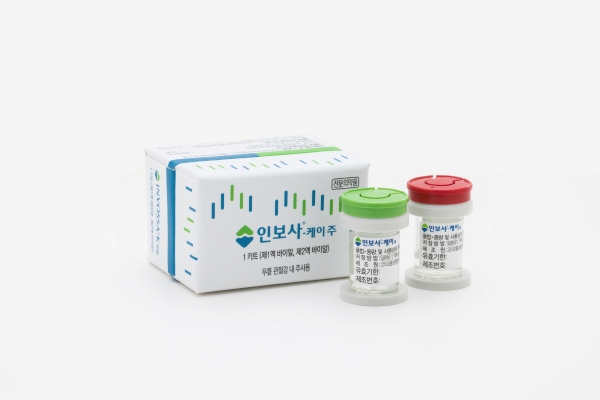
인보사케이주는 코오롱생명과학의 자회사 코오롱티슈진이 개발한 국산 신약 29호로 2017년 7월 식약처로부터 국내 첫 유전자치료제로 품목허가를 받았다. 주성분이 1액과 2액으로 구성되어 있으며, 1액은 동종유래 연골세포이며 2액은 ‘세포조직을 빨리 증식하게 하는 인자(TGF-β1 유전자)’가 도입된 동종유래 연골세포다.
식약처는 인보사의 주성분 중 바뀐 세포 1개 성분이 허가받은 유전자 도입 연골세포가 아닌 ‘TGF-β1 유전자가 삽입된 태아신장유래세포주(GP2-293세포)’로 추정된다고 전했다.
이와 관련 회사측은 신장세포(TGF-β1 유전자 인위적으로 삽입)로부터 TGF-β1 유전자를 분리·정제하여 연골세포에 삽입하는데, 이 과정에서 분리 정제 미비로 신장세포의 일부 혼입돼 당초 만들려던 연골세포를 신장세포로 대체하게 됐다고 해명했다.
식약처 관계자는 “미국에서도 국내 유통된 동일 제품에 대한 검사를 실시하고 있으며 오는 15일 경 결과가 통보될 예정”이라며 “세포의 확인 및 원인 조사를 철저하게 실시할 예정”이라고 밝혔다.
이에 따라 식약처는 병의원 및 건강보험심사평가원에 알려 해당제품이 ‘의약품안전사용서비스(DUR)’ 시스템에 의사가 처방할 수 없도록 해 환자에게 투여되는 것을 차단할 예정이다.
다만 식약처는 해당 제품이 현재까지는 안전성 측면에서 큰 우려는 없는 것으로 판단했다.
식약처에 따르면 인보사는 최초 임상시험 이후 현재까지 11년간 안전성이 우려되는 부작용 보고사례가 없었다. 또 제조과정에서 해당 세포(2액)에 방사선 조사를 통해 안전성을 확보했고 품목허가 시 제출된 독성시험 결과에 특별한 문제가 발견되지 않았다.

![[단독] 부모-자녀 한 동네 사는 실버타운 만든다더니…오세훈표 '골드빌리지' 무산](https://img.etoday.co.kr/crop/140/88/2105453.jpg)



![김장 잘못하다간…“으악” 손목‧무릎 등 관절 주의보 [e건강~쏙]](https://img.etoday.co.kr/crop/140/88/2105671.jpg)
!["아이 계정 삭제됐어요"…인스타그램의 강력 규제, '진짜 목표'는 따로 있다? [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2105286.jpg)
![근무시간에 유튜브 보고 은행가고…직장인 10명 중 6명 '조용한 휴가' 경험 [데이터클립]](https://img.etoday.co.kr/crop/140/88/2105320.jpg)









![김장 잘못하다간…“으악” 손목‧무릎 등 관절 주의보 [e건강~쏙]](https://img.etoday.co.kr/crop/85/60/2105671.jpg)





![[정치대학] 이재명 대안은 김부겸·김동연?…박성민 "둘 다 명분 없다"](https://img.etoday.co.kr/crop/300/170/2105457.jpg)
![서울 명동 임대료, 세계 9번째로 '비싸' [포토]](https://img.etoday.co.kr/crop/300/190/2105411.jpg)