셀트리온은 12일 한국 식약처로부터 자체 개발 중인 종합인플루엔자 항체신약 CT-P27의 임상 2b상 시험에 대한 승인을 획득했다고 밝혔다.
전국 20개 병원에서 약 8개월간 진행하는 이번 임상 시험은 합병증이 없는 급성 인플루엔자 A에 감염된 환자(210명)에게 CT-P27을 투여한 후 치료제의 효능과 안전성을 평가하기 위해 실시된다.
셀트리온은 건강한 피험자를 대상으로 한 2a 임상에서 CT-P27 투약군에서 체내 바이러스 농도가 대폭 감소하는 효과를 확인했다.
셀트리온은 인플루엔자 발병률이 높아지는 동절기 중 2b상 임상에 참여할 인플루엔자 A 감염환자를 모집해 대상군에 CT-P27과 위약을 투여하고 부작용, 활력징후, 심전도, 혈액검사 결과 등을 수집 분석해 약품의 유효성과 안전성을 평가할 계획이다.
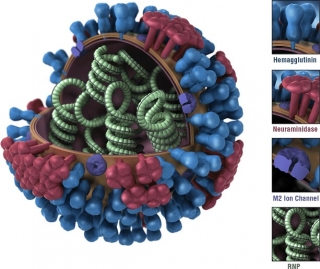
한편 셀트리온이 개발중인 CT-P27은 두 항체로 이뤄진 복합 항체치료제다. CT-P27의 항체는 바이러스의 표면단백질인 헤마글루티닌(hemagglutinin)의 축(stem) 부분에 결합해 바이러스 유전체가 세포 내에 침투하지 못하도록 막는다.
헤마글루티닌의 축은 변이가 일어나지 않기 때문에 CT-P27은 바이러스의 변이 여부에 관계없이 대부분의 인플루엔자에 치료효과를 보일 것으로 기대된다.
셀트리온은 이미 미국 CDC, 중국 정부 연구기관 등과 함께 실시한 비임상 및 임상 시험에서 CT-P27이 조류 독감을 포함해 지난 수십 년간 발생한 유행성 및 계절성 바이러스, 인간에게 전염된 적이 있는 인플루엔자 대부분(H1, H2, H3, H5, H7 및 H9)에 효과가 있음을 확인했으며, 이에 따라 CT-P27이 타미플루 등 기존 약제를 대체할 수 있을 것이라고 기대하고 있다.
통상 새로운 인플루엔자가 유행할 때 효과를 보이는 새로운 백신을 개발∙생산하는 데에는 약 6개월 이상의 시일이 소요된다. 이러한 이유로 각국 정부는 인플루엔자 유행 시 초기 치료에 어려움을 겪어왔다.
셀트리온 관계자는 "항체 치료제의 경우 미리 생산해 의약품을 비축할 수 있고 바이러스 유행 시 즉시 투약할 수 있다는 장점이 있어 CT-P27이 제품화 될 경우 전 세계적으로 활용할 수 있는 혁신적인 인플루엔자 치료제가 될 전망"이라고 말했다.
신종플루가 유행했던 2009년 한국에 타미플루와 리렌자가 기록한 매출은 총 1800억원에 달하며, 로슈는 같은 해 타미플루 판매로 전세계적으로 3조원 이상의 매출을 올린 바 있다.

![“계란은 농업 전환의 압축 모델”…에그테크코리아 2025 개막 [2025 에그테크]](https://img.etoday.co.kr/crop/140/88/2270608.jpg)










![2026년 원전 텐베거 잭팟주 후보! '이 주식'에서 노리세요! ㅣ 이영훈 iM증권 이사 [찐코노미]](https://i.ytimg.com/vi/73yJ8EsmQdM/mqdefault.jpg)
![농심·대한제분·CJ·SPC 등 대거 참여...“즐길거리 많아 눈호강 입호강”[2025 에그테크]](https://img.etoday.co.kr/crop/85/60/2270799.jpg)






![한재용 서울대 동물생명공학부 교수 “계란은 하나의 우주, 모든 에너지 응축돼 있어”[2025 에그테크]](https://img.etoday.co.kr/crop/85/60/2270775.jpg)


![[케팝참참] 공식 깨진 2025년 K팝…"신인이 주인공"](https://img.etoday.co.kr/crop/300/170/2270293.jpg)
![에그테크코리아 2025, 에그테크 심포지움 [포토]](https://img.etoday.co.kr/crop/300/190/2270810.jpg)