소프트웨어 심사만으로 가상현실(VR)ㆍ증강현실(AR) 기술이 적용된 의료기기가 허가될 전망이다.
식품의약품안전처는 가상ㆍ증강현실 의료기기가 점차 증가하면서 ’가상ㆍ증강현실 의료기기‘에 대한 안전성 검증 방법을 개선하고 임상시험 대상을 명확히 하는 내용을 반영해 ’의료기기의 허가ㆍ심사 가이드라인‘을 30일 개정했다.
이번 개정의 주요 내용은 △가상ㆍ증강현실 의료기기 소프트웨어 등 심사 대상 △임상시험이 요구되는 사례 △사용자의 안전을 위한 ’사용방법‘ 및 ’사용 시 주의사항‘ 기재사항 안내 등이며, 업체 면담 및 옴부즈만 제도를 통해 수렴한 결과를 반영했다.
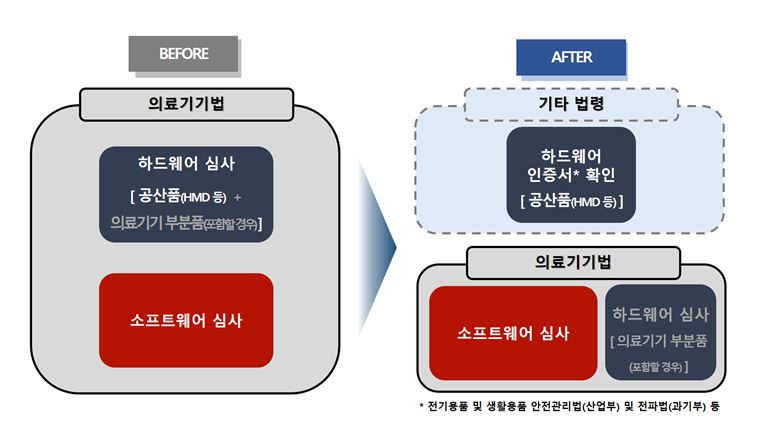
기존에는 전기를 사용하는 의료기기의 경우 전기 및 전자파 안전에 관한 자료를 의무적으로 제출해야 했지만, 개정법에 따라 가상ㆍ증강현실 소프트웨어가 ‘헤드 마운트 디스플레이(HMD)’ 및 모바일기기 등 공산품에 사용되면 공산품은 타 법령에 따라 발급된 안전 인증서 유무만 확인하고 의료기기에 해당하는 소프트웨어만 심사하게 된다.
업체가 가장 많은 부담을 느꼈던 임상시험 분야와 관련해선 임상시험이 요구되는 사례를 명확히 제시하고 새로운 장치를 사용하더라도 임상시험이 면제되는 사례도 안내한다.
아울러 의료기기 사용자의 안전을 위해 사용 전 소독 및 환자 사용 시 주의사항 등 ‘사용방법’과 ‘사용 시 주의사항’에 반드시 기재해야 할 정보를 구체적으로 제시한다.
식약처는 “이번 가이드라인을 통해 첨단기술이 적용된 의료기기가 신속하게 허가될 수 있을 것으로 기대한다”라며 “앞으로 새로운 의료기기 특성을 반영한 안내서 등을 지속 발간할 계획”이라고 말했다.

![최종화 앞둔 '흑백요리사2'…외식업계 활력 불어넣을까 [데이터클립]](https://img.etoday.co.kr/crop/140/88/2281040.jpg)
!["새벽 4시, 서울이 멈췄다"…버스 파업 부른 '통상임금' 전쟁 [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2280696.jpg)




![무너진 ‘가족 표준’…대한민국 중심가구가 달라진다 [나혼산 1000만 시대]](https://img.etoday.co.kr/crop/140/88/2280584.jpg)
![[단독] 숏폼에 쇼핑 접목…카카오, 숏폼판 '쿠팡 파트너스' 만든다 [15초의 마력, 숏폼 경제학]](https://img.etoday.co.kr/crop/140/88/2280591.jpg)



![에코프로 '이때' 무섭게 오를 수 있습니다. 뜻밖에 만날 호재와 상승 모멘텀 분석해드립니다 ㅣ 윤석천 경제평론가 [찐코노미]](https://i.ytimg.com/vi/F5mfHb3Z8_o/mqdefault.jpg)









![최종화 앞둔 '흑백요리사2'…외식업계 활력 불어넣을까 [데이터클립]](https://img.etoday.co.kr/crop/300/170/2281040.jpg)
!['2026 중소기업인 신년인사회' [포토로그]](https://img.etoday.co.kr/crop/300/190/2281137.jpg)