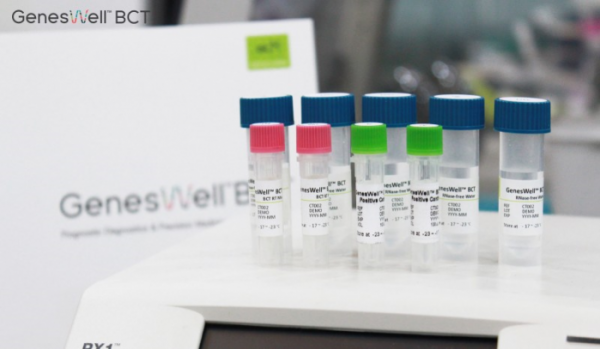
젠큐릭스는 화이자의 유방암 치료제인 '입랜스'(성분명 팔보시클립)의 내분비 병용요법에 대한 평가와 젠큐릭스의 유방암 예후진단 검사인 진스웰 BCT의 약물 효능 표지자로서의 성능을 분석하는 임상시험을 내년 1월 개시한다고 밝혔다.
이번 임상시험은 2월 식품의약품안전처로부터 의약품 임상 승인, 4월 의료기기 임상 승인을 각각 받았다. 이번 임상 시험은 삼성서울병원을 포함한 국내 다기관에서 578명의 조기 유방암 환자를 대상으로 진행될 예정이다.
입랜스는 치료 옵션이 제한적이었던 HR+/HER2- 유방암 분야에서 기존 단독요법 대비 약 2배 이상 개선된 무진행 생존기간 중간값(mPFS)으로 병용 효과를 확인한 전이성 유방암 치료제다.
기존 항암화학요법보다 항암 효과가 우수하면서도 부작용이 적고 하루 한 번 복용하는 경구제로 환자의 복약 편의성이 뛰어나다는 평가를 받고 있다.
젠큐릭스의 진스웰 BCT는 조기 유방암 환자의 원격전이 위험성을 예측하는 바이오마커 기반 예후예측 분자진단검사로 한국인 환자를 대상으로 임상적 유효성이 검증된 유일한 검사다. 국내 최초 식약처 의료기기 3등급 품목 허가와 유럽 인증(CE-IVD)를 획득했다.
이번 임상시험은 수술을 받은 HR+/HER2-, 림프절 전이 3개 이하의 조기 유방암 환자를 대상으로 시행되며, 3년 무사건 생존 분석을 통해 진스웰 BCT 고위험군에 대한 입랜스의 효능을 평가한다. 기존 전이성 유방암 환자에게만 처방되됐 입랜스가 고위험군 조기 유방암 환자에게 확대 처방될 수 있을지에 대한 가능성도 타진할 수 있을 전망이다.
조상래 젠큐릭스 대표는 “이번 임상은 한 임상에 대해 식약처로부터 의약품과 의료기기 임상시험을 동시에 승인 받은 국내 첫 사례”라며 “글로벌 제약사 화이자에서도 대규모 투자를 통해 공동으로 진행되는 이번 임상시험 결과를 바탕으로 화이자와 더욱 긴밀히 협력해 글로벌 시장 진출에도 박차를 가할 계획”이라고 말했다.
코스닥 이전상장을 위해 최근 기술성 평가를 진행 중인 젠큐릭스는 진스웰 BCT가 한국인을 포함한 동양인 유방암 환자에게 더욱 적합한 검사라는 점을 내세워 아시아 시장 진출에 박차를 가하고 있다. 중국 및 일본의 종합병원들과 공동임상연구를 진행 중이며, 올해 홍콩, 베트남, 태국, 필리핀 등 동남아시아에서도 판매대리점을 지정해 현지 영업활동을 활발히 펼치고 있다.



![1인 가구 청년들을 위한 다양한 소통 프로그램 '건강한 밥상' [십분청년백서]](https://img.etoday.co.kr/crop/140/88/2096058.jpg)
![서울에는 김밥·구미에는 라면…주말 분식 축제 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2096164.jpg)

![“금투세, 폐지 대신 공제 늘리자”…野 ‘절충 법안’ 속속 발의 [관심法]](https://img.etoday.co.kr/crop/140/88/2096148.jpg)




![2차전지 새로운 주도주 등장하나, 분야별 탑픽은 '이것' ㅣ 이창환 iM증권 영업부장 [찐코노미]](https://i.ytimg.com/vi/ZiFpzTXCCMY/mqdefault.jpg)







![[BioS]와이바이오, ‘B7-H3 ADC’ 발굴 “월드ADC서 공개”](https://img.etoday.co.kr/crop/85/60/2096367.jpg)
![서울에는 김밥·구미에는 라면…주말 분식 축제 [그래픽 스토리]](https://img.etoday.co.kr/crop/300/170/2096164.jpg)
![함용일 금감원 부원장, 고려아연 경영권 분쟁 등 자본시장 현안 관련 브리핑 [포토]](https://img.etoday.co.kr/crop/300/190/2096151.jpg)