메디컬 에스테틱 전문 바이오 기업 이니바이오가 코로나19의 악조건에도 불구하고 해외진출 확장과 차세대 제형 개발에 박차를 가하고 있다.
특히 진입 장벽이 높아 블루오션 시장으로 꼽히는 중동 지역에 보툴리눔 톡신 기업으로는 국내 최초로 할랄인증 절차를 추진하고 있어 주목된다.
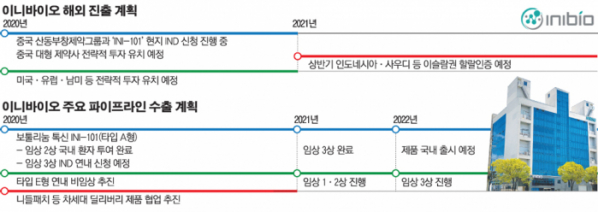
24일 이니바이오에 따르면 20억 무슬림 시장 개척과 할랄인증을 겨냥해 연구개발 단계부터 동물성 유래 성분을 배제한 식물성 유래 성분을 기반으로 연구개발ㆍ생산ㆍ제조를 진행하고 있다.
할랄인증은 의약품에도 적용돼 돼지고기나 알코올 성분이 없어야 한다. 보툴리눔 균 역시 동물성 유래 성분을 포함한 배지에서 배양하기 때문에 보툴리눔 톡신 기업들의 할랄 인증 도전은 쉽지 않다. 이니바이오 관계자는 “인도네시아, 사우디아라비아 등 이슬람권의 이미용에 대한 관심은 급증하고 있지만 정부에서 동물성 유래성분이 들어간 보툴리눔 톡신을 제한하고 있어 시장 활성화가 더딘 상황”이라며 “자사의 식물성 유래 성분 기반 제품에 사우디와 인도네시아 대형 제약사들이 큰 관심을 보이고 있다. 특히 인도네시아의 경우 이니바이오의 보툴리눔 톡신 핵심 파이프라인인 ‘INI-101(타입 A형)’ 임상 2상 결과가 마무리되는대로 할랄 인증을 추진하기로 해 할랄 인증기간을 감안하면 내년 상반기에 관련 승인을 받을 것으로 전망된다”고 밝혔다.
이와 함께 이니바이오는 중국 임상에도 속도를 내고있다.
중국 상장 제약사인 산동부창제약그룹과 손잡고 임상(1~3상) 및 판매전략으로 중국시장을 공략한 이니바이오는 7~8월 중 INI-101에 대한 IND(임상시험계획) 신청을 마무리하고 임상을 본격화 할 예정이다. 또한 빠른 중국 시장 진입을 위해 중국 대형 제약사와 전략적 투자 유치도 계획 중이다.
이 관계자는 “한국과 동시에 진행 중인 중국 임상계획이 차질없이 진행되고 있다. 더불어 빠른 시장 진입을 위해 현지 제약사들과 전략적 유치를 계획 중”이라고 전했다.
미국, 유럽, 남미 진출을 위해 주요 기업들과 파트너십 및 전략적 투자 유치도 협의 중으로 연내에 관련 계약들이 이어질 것으로 회사는 내다보고 있다.
이러한 해외 진출 계획에 발맞춰 이니바이오는 임상과 제형 개발에도 심혈을 기울이고 있다.
이니바이오는 최근 임상 2상 환자투여가 완료된 INI-101에 이어 차세대 보툴리눔톡신인 타입 E형에 대한 연구개발도 완료하고 연내 비임상을 진행한다는 목표다.
기존 톡신 시장의 주제품인 타입 A형은 주사 후 3일 이후에 효과가 발현돼 약 6개월의 지속시간을 유지하지만 타입 E형은 24시간 이내에 효과가 나타나 약 4주 정도의 지속시간을 가지는 속효성 타입으로 치료용에 적합하다. 점차 확장되고 있는 치료용 시장 선점을 위해 현재 해외에선 프랑스 기업 입센과 미국의 애브비(미국 앨러간 인수)가 타입 E형 임상을 진행 중이다.
이니바이오 관계자는 “연내 INI-101 한국 임상 3상의 IND 신청을 완료하고, 2022년 내 제품 출시를 목표로 사업을 추진하고 있다. 한국에서 3상이 완료되는 내년 하반기에는 미국 식품의약국(FDA) 허가 신청도 추진할 계획”이라며 "이를 위해 현재 보유 중인 자사 균주의 공식적인 수입처와 전체 염기서열을 식약처에 모두 제출한 상태"라고 전했다. 또한 그는 “글로벌 시장 진출을 목표로 보툴리눔톡신 타입 E형의 연구개발 및 제품화와 함께 차세대 제형 개발에도 공을 들이고 있다”며 “니들패치형과 같은 차세대 딜리버리 제품과의 협업도 추진중” 이라고 덧붙였다.
한편 이니바이오는 올 하반기 시장 진입 및 매출 확대와 수익 개선을 위해 GMP(의약품 제조,품질 관리 기준)와 수출허가 신청을 완료했으며, 현재 식약처의 실사 및 점검이 진행 중이다. 아울러 기술성 입증을 위한 IPO 추진을 위해 외부 감사인에 삼일 PWC를, 상장 주관사는 9월 중 선정할 계획이다.


!['핵심 두뇌' 美·中으로…한국엔 인재가 없다 [韓 ICT, 진짜 위기다下]](https://img.etoday.co.kr/crop/140/88/2107847.jpg)

![교통비 또 오른다?…빠듯한 주머니 채울 절약 팁 정리 [경제한줌]](https://img.etoday.co.kr/crop/140/88/2107738.jpg)

!["비트코인 살 걸, 운동할 걸"…올해 가장 많이 한 후회는 [데이터클립]](https://img.etoday.co.kr/crop/140/88/2107772.jpg)
















![[집땅지성] '제2의 용산' 광운대역세권 개발…10년 뒤 얼마나 오를까?](https://img.etoday.co.kr/crop/300/170/2107824.jpg)
!['기상관측 117년만' 역대 11월 중 가장 많은 눈 쌓인 서울 [포토]](https://img.etoday.co.kr/crop/300/190/2107766.jpg)